au sommaire
Variabilité génétique des virus influenza
Les virus influenzainfluenza sont pourvus d'une grande plasticité génétiquegénétique. La dérive génétiquedérive génétique et les réassortiments géniquesgéniques sont les mécanismes connus contribuant à leurs variations antigéniques (Abed, Hardy et al. 2002 1) (Van and Manuguerra 2000 59).
La dérive génétique (ou glissement antigénique)
La dérive génétique est la conséquence du caractère peu fidèle de l'enzyme ARN polyméraseARN polymérase, ARN dépendante dont les erreurs de lecture commises au cours de la réplicationréplication virale ne sont pas réparées ; elle résulte également de la pression de sélection exercée par les anticorpsanticorps neutralisants sur les sites antigéniques de l'HA (Al Faress, Cartet et al. 2005 2). Ces erreurs aboutissent à des mutations ponctuelles au niveau des bases nucléotidiques des gènesgènes viraux et par conséquent à des modifications au niveau des protéinesprotéines pour lesquelles ils codent.
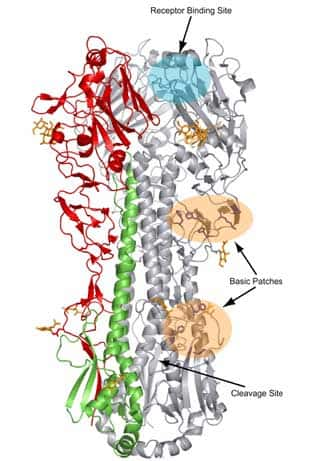
Ces variations antigéniques sont mineures, surviennent environ tous les deux à trois ans et apparaissent essentiellement pour l'hémagglutininehémagglutinine et à moindre titre pour la neuraminidaseneuraminidase. Tous les gènes codant pour les autres protéines virales peuvent à priori subir des mutations, dans la limite où les protéines codées par ces gènes conservent des fonctions compatibles avec la réplication virale.
Le glissement antigénique concerne un sous-type, pour lequel apparaissent des variants successifs qui diffèrent progressivement de la souche d'origine. Il concourt à l'apparition d'épidémiesépidémies annuellesannuelles limitées en raison de l'échappement partiel du virus à la réponse immunitaireréponse immunitaire de l'hôte. Il apparaît que chaque nouveau variant de virus grippal A, capable de réinfecter un individu préalablement exposé, présente au moins quatre substitutions d'acides aminésacides aminés au niveau d'au moins deux sites antigéniques de l'hémagglutinine.
L'étude de l'évolution génétique de l'hémagglutinine des virus grippaux humains A (H1N1) et A (H1N2), isolés dans le sud de la France au cours des hivershivers 2001 à 2004, met en évidence 28 substitutions d'acides aminés au niveau de la région HA1 des virus A (H1N1) ou A (H1N2) exclusivement, voire des deux. Par ailleurs, neuf isolats A (H1N2) présentent une substitution de l'acide aminé en position 90 ; il en résulte l'introduction d'un nouveau site de glycosylation adjacent au site antigénique E de HA, et la possibilité d'une modification de l'antigénicité du virus A (H1N2) (Al Faress, Cartet et al. 2005 2).
Le taux d'évolution des virus influenza aviaires est beaucoup plus important chez les volailles que chez l'hôte naturel, représenté par les oiseaux sauvages (Suarez, Van et al. 2000 50). Les erreurs dans les gènes codant la neuraminidase et l'hémagglutinine sont les plus fréquentes.
La cassure antigénique (ou saut)

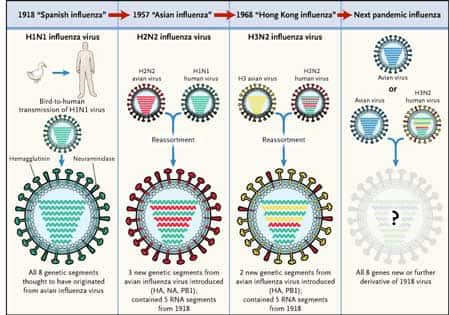
Le réassortiment à l'origine des pandémies de grippe. © DR
Elle est rendue possible par le caractère segmenté du génomegénome des virus grippaux et constitue le second mécanisme de variation antigénique. Elle correspond au remplacement complet d'un ou plusieurs gènes d'une souche virale par un gène équivalent d'une autre souche virale. Ce réassortiment génétique peut conduire à l'apparition de nouveaux sous-types de virus et être à l'origine de pandémiespandémies de grippe : la grippe asiatique en 1957 et la grippe de Hong Kong en 1968 (Laver and Garman 2002 33).
Le virus de la grippevirus de la grippe asiatique est issu du réassortiment entre les gènes PB1, HA et NA de la souche aviaire A (H2N2) et des cinq autres gènes du virus grippal humain saisonnier A (H1N1) ; le virus de la grippe de Hong Kong possède les gènes HA et PB1 de virus aviaire A (H3) et les six autres gènes du virus grippal humain circulant A (H2N2) ; ces réassortiments génétiques ont permis l'émergenceémergence des sous-types H2N2 et H3N2 respectivement (Russell and Webster 2005 46) (Kawaoka, Krauss et al. 1989 26).
L'analyse phylogénétiquephylogénétique des huit segments du génome des virus humains A (H2N2), isolés entre 1957 et 1968 et des virus humains A (H3N2) isolés entre 1968 et 1972 montre que le sous-type A (H2N2) continue de circuler après 1968 et l'émergence des virus A (H3N2) chez l'homme est associée à de multiples réassortiments qui contribuent à leur diversité génétique (Lindstrom, Cox et al. 2004 36).
Depuis 1977, les souches circulant dans la population humaine mondiale sont de sous-types A (H1N1) essentiellement, virus réapparu à l'occasion de la « grippe russe », et de type A (H3N2). Cette situation est propice aux réassortiments génétiques en cas d'infection concomitante par les deux virus. En 1983, un premier et unique cas d'infection par un virus réassorti A (H1N2) est diagnostiqué sur un prélèvement pharyngé chez un patient coinfecté par les virus A (H1N1) et A (H3N2). Durant la saisonsaison grippale 2000-2001, des virus réassortis A (H1N2) ont été isolés sur tous les continents, le virus s'étant propagé d'Asie du sud vers l'Afrique, l'Europe et l'Amérique du nord. Les études virologiques ont démontré la proximité antigénique et génétique d'une part, de l'hémagglutinine du virus réassorti A (H1N2) avec celle de la souche vaccinalesouche vaccinale actuelle A (H1N1), et de la neuraminidase de A (H1N2) avec celle de la souche prototype A (H3N2) d'autre part. Les six autres gènes internes sont issus d'un virus A (H3N2) (Xu, Lindstrom et al. 2004 61)