au sommaire
- À lire aussi
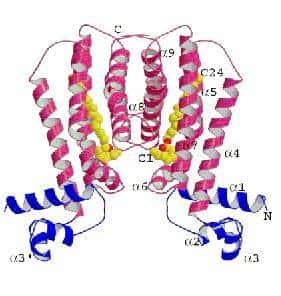
Structure cristalline du répresseur EthR (en rouge et bleu) associé au ligand (en jaune) (crédit : Frénois et al./Neuron)
Avec plus de 2 millions de morts par an dans le monde, la tuberculose reste la première cause de mortalité liée à un agent infectieux unique. Si les traitements antibiotiques ont largement contribué à contenir la pandémie, ils ont aussi, dans certains cas, favorisé l'émergenceémergence de souches multirésistantes, plus particulièrement dans les pays en développement ou dans certaines populations des pays industrialisés paupérisées par les crises économiques. Ces cas nécessitent l'usage d'antibiotiques de seconde ligne, c'est-à-dire moins efficaces et généralement plus toxiques pour le malade.
L'éthionamide (ETH), l'un de ces antibiotiques de seconde ligne, présente une importante toxicité hépatique aux doses requises pour l'élimination des bacilles tuberculeux multirésistants
Une équipe de l'Institut Pasteur de Lille animée par Alain Baulard (Inserm) et Vincent Villeret (CNRS) propose une approche originale pour augmenter la sensibilité des bacilles à l'ETH et ainsi permettre l'usage de cet antibiotique à des doses moins toxiques.
L'ETH est une pro-droguedrogue, ce qui signifie que pour acquérir son pouvoir antibactérien, elle doit subir un processus d'activation par une enzymeenzyme de la bactériebactérie. Dans une étude précédente, le groupe d'Alain Baulard avait montré que c'est l'enzyme EthA de la bactérie Mycobacterium tuberculosisMycobacterium tuberculosis qui est responsable de l'activation de l'ETH (Baulard et al, Journal of Biological Chemistry 275, 28326-28331, 2000). Cette même équipe a ensuite montré que l'activation de l'ETH par EthA est contrôlée par une seconde protéineprotéine, appelée EthR (Engohang-Ndong et al. Molecular Microbiology 51, 175-188, 2004).
Les chercheurs ont maintenant résolu la structure tridimensionnelle de EthR par cristallographiecristallographie aux rayons Xrayons X et révèlent que dans certaines conditions expérimentales, EthR est neutralisée par une moléculemolécule appelée ligandligand. Associée à ce ligand, EthR n'est plus capable de bloquer l'activation de l'ETH, qui peut alors développer pleinement son action antibiotique. Lorsque des bactéries sont traitées par l'ETH en présence d'une molécule synthétique simple dérivée de ce ligand, les bactéries sont plus sensibles à l'ETH, c'est-à dire que des doses plus faibles d'ETH peuvent être utilisées pour tuer les bactéries dans ces conditions.
Les chercheurs espèrent pouvoir utiliser cette synergiesynergie d'activité pour réduire la dose thérapeutique de l'ETH et de ses dérivés, ce qui limiterait l'apparition des effets toxiques indésirables lors du traitement de la tuberculose ou de la lèprelèpre, soumise aux mêmes limitations thérapeutiques.