au sommaire
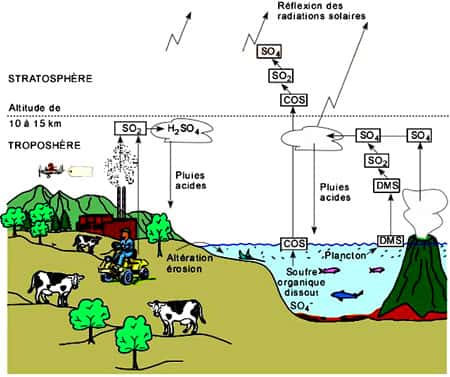
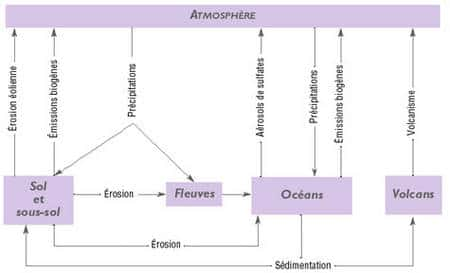
Le soufre existe dans le sol. Les micro-organismesmicro-organismes transforment le soufre sous des formes solubles et gazeuses. Dans la biosphèrebiosphère, le soufre circule essentiellement sous forme d'hydrogène sulfuré, de dioxyde de soufre et de sulfates.

Dans la plupart des sols, le soufre est un élément rare qui provient de la décomposition de la roche-mère contenant des minérauxminéraux soufrés (pyritespyrites par ex.). La principale source pour les organismes vivants sont les sulfates, solubles, et seule forme de soufre inorganique disponible. Absorbés par les plantes ils sont transformés en acides aminésacides aminés sulfurés : cystine, cystéinecystéine et méthionineméthionine.
Ce soufre est ensuite restitué au sol par les micro-organismes (sulfobactéries) qui réduisent le soufre organique (acides aminés) en hydrogène sulfuré. L'hydrogène sulfuré se dégage dans l'air ou dans l'eau, ou est transformé en produits dont l'oxydation aboutit à des sulfates. Le cycle du soufre présente aussi une phase sédimentaire. Lorsqu'il précipite en milieu anaérobie en présence de fer, le soufre s'accumule sous forme de FeS2, qui pourra être réintroduit dans le cycle par l'érosion des sols et le volcanismevolcanisme.
Le diméthylsulfure (DMS)
C'est un gazgaz qui a un effet refroidissant sur le climatclimat en contribuant à la formation de nuagesnuages. Le DMSDMS est produit dans les océans par la dégradation du diméthylsulfoniopropionate (DMSP) synthétisé par certains phytoplanctonsphytoplanctons. Plusieurs de ces alguesalgues peuvent convertir le DMSP en DMS, dans la plupart des cas, la conversion en DMS se fait par des bactériesbactéries qui l'utilisent comme source de soufre. Les variations de la production biologique de DMS ont été étudiés dans le Saint-Laurent, le Pacifique nord-est et l'Atlantique nord-ouest. Il finit par se transformer en sulfate.
Le sulfure de carbonyle
Gaz volcanique, il aide les acides aminés à former des chaînes. Luke Leman et ses collègues ont démontré qu'une solution aqueusesolution aqueuse d'acides aminés, exposée au sulfuresulfure de carbonyle, peut produire des liaisons contenant au moins deux acides aminés, dans des concentrations de 80 % à température ambiante. Des ionsions métalliques ont intensifié la réaction. Le sulfure de carbonyle n'est pas accumulé dans l'atmosphèreatmosphère, il aurait donc eu un effet sur des acides aminés près d'éruptions volcaniqueséruptions volcaniques, formant des chaînes peptidiques sur des rochers avoisinants, processus que les chercheurs appellent « polymérisationpolymérisation sur les rochers ». Il est aussi produit à partir des sulfures organiques dissous dans l'eau de mer. Il finit par se transformer en sulfates.
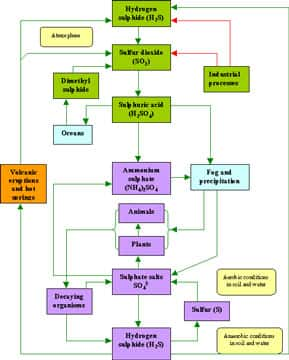
Le dioxyde de soufre SO2
Ce gaz résulte :
- de la combustioncombustion de matièresmatières fossilesfossiles contenant du soufre (charboncharbon, fuelfuel, gazole...) ;
- de procédés industriels.
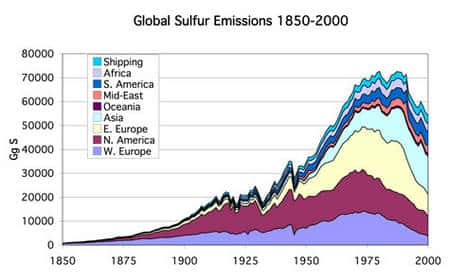
En France, les concentrations en SO2 ont diminué de 50 % depuis 15 ans. C'est un gaz irritant, associé à une altération de la fonction pulmonaire chez l'enfant et à une exacerbation des symptômessymptômes respiratoires chez l'adulte. En présence d'humidité, il forme de l'acide sulfuriqueacide sulfurique et contribue au phénomène des pluies acides et à la dégradation des arbresarbres, de la pierre et des constructionsconstructions.
Normes en vigueur
Recommandations de l'OMSOMS
- dioxyde de Soufre - SO2 ;
- objectif de qualité 50 µg/m3 moyenne annuelleannuelle ;
- valeur limite 125 µg/m3 moyenne journalière ;
- seuil d'information 350 µg/m3 moyenne horaire ;
- seuil d'alerte 500 µg/m3 moyenne quart-horaire.
Recommandations du Conseil Supérieur d'Hygiène Publique de France (CSHPF)
- objectif de qualité 50 µg/m3 moyenne annuelle ;
- valeur limite 125 µg/m3 moyenne journalière ;
- seuil d'information 250 µg/m3 moyenne horaire ;
- seuil d'alerte 350 µg/m3 (sur 3 heures consécutives) Moyenne horaire.