au sommaire

Grippe : production de souches vaccinales et essais cliniques
La recherche poursuit les essais cliniques pour les vaccins antigrippaux. En voici quelques exemples.

La production de souches vaccinales contre les virus A (H5N1) et A (H9N2)
On peut considérer quatre approches pour la génération de vaccinsvaccins dirigés contre le virus influenzavirus influenza A (H5N1).
1. Un vaccin inactivé élaboré à partir d'une souche A (H5N1) isolée chez l'homme.
La faisabilité de cette approche pose deux problèmes : elle est tout d'abord limitée techniquement par la létalité du virus sur les embryonsembryons de poulet et sa croissance insuffisante pour sa propagation dans les oeufs fertilisés ; la manipulation de souches virales hautement pathogènespathogènes soulève la question de la sécurité des personnels de laboratoire et requiert un niveau de confinement trois au minimum.
2. Un vaccin inactivé préparé à partir d'une souche virale avirulente.
La souche de base est antigéniquement proche d'une souche virale A (H5N1) isolée chez l'homme et capable d'induire la fabrication d'anticorpsanticorps contre la souche pathogène (comme le vaccin issu de la souche A/duck/Singapore/97 (H5N3)).
3. L'utilisation de l'hémagglutininehémagglutinine HA comme molécule immunogène unique :
- dans un vaccin à ADNADN nu ou vaccin génétiquegénétique : le gènegène de HA est introduit directement dans l'organisme, le plus souvent dans les cellules musculairescellules musculaires par voie intramusculaire ; le vaccin est produit, in situ, dans l'organisme à immuniser ;
- par la production d'une hémagglutinine recombinante dans un système d'expression de type adénovirusadénovirus humain, dans lequel le gène codant pour HA est inséré dans le génomegénome du vecteur viral, qui exprimera ensuite HA à sa surface. Le vecteur est inclus dans le vaccin, injecté par voie intramusculaire ou par voie intranasale, agit comme un système de délivrance d'antigènesantigènes au système immunitairesystème immunitaire ;
- par la production d'une hémagglutinine recombinante dans un système d'expression de type baculovirus (Nwe, He et al. 2006 51) dans lequel un baculovirus génétiquement modifié pour l'expression de HA est introduit et propagé dans des cellules d'insectesinsectes en culture. La protéineprotéine recombinante exprimée est ensuite extraite et purifiée, et peut servir de base à des vaccins sous-unitéssous-unités ; elle est souvent administrée avec un adjuvantadjuvant qui potentialise leur pouvoir immunogène.
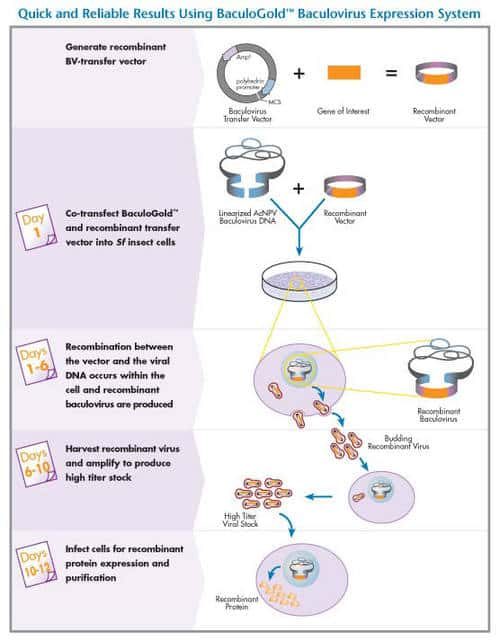
4. Un vaccin conventionnel préparé à partir de virus réassortis à haut potentiel de multiplication
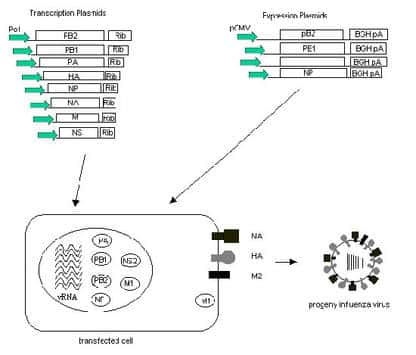
Ces virus sont porteurs des gènes HA et NA d'une souche A (H5N1) isolée chez l'homme et des gènes internes d'une souche vaccinalesouche vaccinale mère telle que PR8 ou A/Ann Arbor/6/60 adaptée au froid (Shengqiang, Chongguang et al. 1999 55). L'hémagglutinine est rendue avirulente par une modification de la séquence qui code pour son site de clivageclivage (Subbarao, Chen et al. 2003 59) (Horimoto, Takada et al. 2005 31) (Lipatov, Webby et al. 2005 40).
En 2002, le CDCCDC d'Atlanta développe par génétique inverse un virus candidat vaccin, proche dans son principe des vaccins antigrippaux bénéficiant actuellement d'une AMMAMM. Ce virus réassorti est généré par un système à 12 plasmidesplasmides qui comporte : deux plasmides pour NA et HA qui proviennent de la souche A/Hong Kong/491/97 (H5N1) ; le gène HA a subi une délétiondélétion au niveau du motif d'acides aminésacides aminés multibasiques du site de clivage, par mutagénèse dirigée, six plasmides assurent la transcriptiontranscription des six gènes internes de la souche mère PR8, et quatre autres l'expression des protéines PA, PB1, PB2, NP de PR8. La transfectiontransfection a lieu sur culture de cellules 293T et la propagation virale par injection dans des oeufs fertilisés de poulet. Les tests de pathogénicitépathogénicité du virus réassorti H5N1/PR8 montrent que l'altération du motif d'acides aminés multibasiques du gène de l'HA atténue la virulence du virus chez la souris et le poulet, sans en diminuer l'antigénicité. Le vaccin issu de l'inactivation du virus se révèle être immunogène et protège la souris d'une dose létale de la souche sauvage A (H5N1) (Subbarao, Chen et al. 2003 59).
Les vaccins vivants sont une alternative intéressante aux vaccins inactivés. Ils requièrent des doses plus faibles d'antigènes, élicitent une réponse immune plus importante, plus rapide (environ dix jours après la vaccinationvaccination), plus globale (immunitéimmunité cellulaire) que les vaccins inactivés, notamment chez les personnes naïves. Le laboratoire du National Institute of Allergy and Infectious Diseases (NIAIDNIAID)" (Luke and Subbarao 2006 41) développe actuellement un vaccin pandémique, vivant et atténuéatténué, basé sur la souche mère A/Ann Arbor/-/60 (AA) (H2N2), porteuse des gènes HA et NA des virus influenza hautement pathogènes circulants. Leur programme de recherche inclut :
- la génération d'un lot de virus vivants atténués porteurs d'une HA des sous-types 4 à 16, associée à une NA, selon les combinaisons existantes chez les virus de type sauvage, ces deux protéines étant combinées aux autres gènes de la souche mère A/Ann Arbor/-/60 (AA) (H2N2) ;
- la préparation de chaque lot de vaccins pandémiques candidats ;
- l'évaluation chez l'homme de l'innocuité, de l'immunogénicitéimmunogénicité et de la stabilité phénotypique de chaque vaccin.
Des essais précliniques chez la souris ont testé le pouvoir immunogène de vaccins vectorisés utilisant un adénovirus humain non réplicatif comme vecteur d'expression de l'hémagglutinine d'une souche A (H5N1).
- Le vecteur est porteur du gène HA d'une souche A/Hong Kong/156/97 (H5N1) (Hoelscher, Garg et al. 2006 28) ou d'une souche A/Vietnam/1203/04 (H5N1) (Gao, Soloff et al. 2006 23).
- La vaccination induit une sécrétionsécrétion d'anticorps spécifiques anti HA et une stimulationstimulation de l'immunité cellulaire.
- L'immunisation donne une protection efficace contre une dose létale de virus A (H5N1).
- La production du vaccin vectorisé est rapide, 36 jours après la détermination de la séquence du gène viral (Gao, Soloff et al. 2006 23).
Les essais cliniques de vaccins candidats contre les virus hautement pathogènes
Le principe de base de l'efficacité des vaccins antigrippaux humains est de provoquer la synthèse d'anticorps neutralisants dirigés contre l'antigène majeur des virus influenza : l'hémagglutinine HA. Les premières études menées avec les vaccins inactivés dirigés contre des souches isolées en 1997, A (H9N2) et A (H5) ont démontré leur faible pouvoir immunogène comparé à celui des vaccins saisonniers anti-H1N1 et H3N2.
1. Les essais cliniquesessais cliniques de phase I
Réalisés avec un vaccin inactivé entier et un vaccin sous-unité à partir d'un isolat humain A/Hong Kong/1073/99 (H9N2), montrent des taux protecteurs d'anticorps neutralisants et inhibant l'hémagglutination, après injection d'une dose unique de vaccin chez les personnes âgées de plus de 32 ans ; par contre la réponse humorale, chez les sujets âgés de moins de 32 ans est faible et nécessite deux doses de vaccins. Les doses vaccinales ont été testées pour des teneurs en hémagglutinine de 7,5 à 30 μg (Luke and Subbarao 2006 41).
2. En 1997, le virus A/Hong Kong/97 (H5N1) est isolé et mis en cause
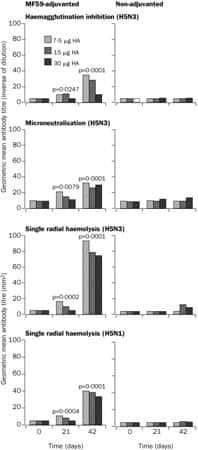
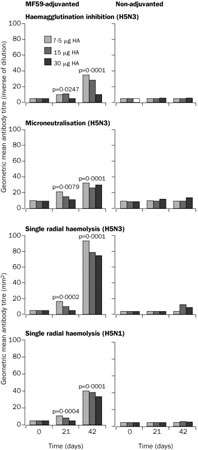
C'est la première fois dans des cas humains de grippe aviairegrippe aviaire ; une souche variante non pathogène du virus, la souche A/Duck/Singapore-Q/F119-3/97 (H5N3) est testée cliniquement en tant que vaccin candidat, en raison d'une similitude antigénique suffisante avec la souche A (H5N1) d'origine humaine et aviaire. Le vaccin sous-unité, sans adjuvant, est faiblement immunogène quelles que soient les doses utilisées. Des taux protecteurs d'anticorps neutralisants sont atteints uniquement par l'utilisation d'adjuvant immunologique, tel le MF59, et deux doses vaccinales de 7,5 μg (Nicholson, Colegate et al. 2001 49).
Réponse humorale au vaccin non adjuvé et au vaccin adjuvé par le MF59. © 2006 Elsevier B.V
3. L'immunogénicité et la tolérance d'un vaccin
L'immunogénicité et la tolérance d'un vaccin exprimant l'hémagglutinine recombinante H5, générée par un système d'expression baculovirus à partir d'un isolat humain, de la souche A/Hong Kong/156/97 (H5N1) ont été testées chez 147 adultes sains ; une immunité protectrice est atteinte uniquement dans 50 % des cas, pour les dosagesdosages les plus élevés d'hémagglutinine (90 μg) et deux doses vaccinales. On peut penser que l'utilisation de doses d'hémagglutinine plus élevées et/ou l'addition d'adjuvants améliorerait la réponse immune (Treanor, Wilkinson et al. 2001 61).
Un certain nombre d'essais cliniques sur des vaccins candidats réalisés à partir des souches A (H5N1) circulant dans le Sud-Est asiatique en 2004 et 2005 sont en cours ou planifiés.
4. En décembre 2005, Sanofi Pasteur a annoncé les premiers résultats
Sanofi Pasteur a annoncé les résultats des études menées en Europe et notamment en France, sur un vaccin prototype inactivé adjuvé (aluminium) contre le virus H5N1virus H5N1, réassorti par génétique inverse, produit par le NIBSC, au Royaume- Uni.
5. Le Japon teste chez l'homme un vaccin contre le virus H5N1
Ce vaccin serait contre le virus H5N1 à virus entier, adjuvé par l'aluminium.
6. Différentes formulations testées en 2006
Les vaccins inactivés entiers ou sous-unités propagés sur culture d'œufs, vaccins produits sur cultures cellulaires, vaccins adjuvés (hydroxyde et phosphatephosphate d'aluminium, MF59), et également des vaccins vivants atténués. Des vaccins candidats contre les souches H7 et H9 sont actuellement à l'étude chez l'homme.
7. Sanofi Pasteur et le projet FLUPAN
Sanofi participe au projet FLUPLAN, financé par l'Union européenne, pour la production d'un vaccin contre une souche A (H7N1) à potentiel pandémique.
8. Test d'un vaccin inactivé
Le laboratoire Chiron expérimente un vaccin inactivé sous-unité A (H9N2) réassorti G9/PR8 ; les taux d'anticorps en inhibitioninhibition de l'hémagglutination sont meilleurs avec le vaccin adjuvé par le MF59, même pour des doses vaccinales basses (de 3,75 à 30 μg).
9. Essais cliniques de phase I en 2005
En avril 2005, le groupe Sanofi-Pasteur, sous contrat avec le National Institute of Allergy and Infectious Diseases (NIAID)), démarre les essais cliniques phase I, d'un vaccin inactivé sous-unité A (H5N1) chez 451 adultes sains. La souche vaccinale a été développée par génétique inverse par le St. Jude Children's Research Hospital (Etats-Unis) à partir du virus isolé en 2004, A/Vietnam/1203/04 (H5N1). Les résultats préliminaires attestent de l'innocuité du vaccin candidat et de sa capacité à induire une réponse immune protectrice avec un protocoleprotocole de deux doses de 90 μg chacune. Les données complètes sont attendues en 2006. Des essais sont prévus par la suite chez l'enfant et la personne âgée (Enserink 2005 17) (Quirk 2005 54).
10. d'autres essais cliniques de phase I
Des essais cliniques de phase I sont étudiés avec un vaccin candidat vivant atténué A (H9N2) issu du réassortiment entre les virus A/chicken/Hong Kong/G9/97 et la souche mère A/Ann Arbor/6/60 ca.
Les vaccins génétiques antigrippaux ne sont qu'à un stade précoce de développement, en raison du trop faible pouvoir immunogène chez l'homme de l'ADN nu.