au sommaire
L'équipe américano-allemande qui vient de créer cette sorte de gruyère de germaniumgermanium n'est pas prolixe de détails sur la méthode employée, si ce n'est qu'elle ne requiert qu'une température de 300 °C. Alors que le germanium à l'état naturel présente une structure atomique régulière, similaire à celle du diamantdiamant, celui-ci prend la forme de clathrateclathrate (du grec klathron, signifiant clos), c'est-à-dire un arrangement dans lequel les atomesatomes créent entre eux de minuscules volumesvolumes fermés. Dans les clathrates connus jusqu'ici, ces petites espaces abritent des moléculesmolécules dites hôtes, qui empêchent les cages de s'effondrer sur elles-mêmes. Mais dans la structure réalisée par Arnold Guloy, de l'université de Houston (Etats-Unis), et une équipe de l'Institut Max PlanckMax Planck (Dresde, Allemagne), les cages sont vides et pourtant ne s'écrasent pas...
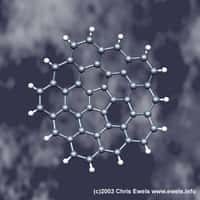
Dans ce clathrate de germanium, les atomes forment des cages n'emprisonnant qu'un espace vide. Outre une très faible densité, cette structure inédite apporte son lot de propriétés originales.
Crédit : Michael Baitinger, Max Planck Institue für Chemische Physik fester Stoffe
Aider la nature à faire mieux
Depuis plusieurs années, on cherche à réaliser de telles structures avec les deux plus célèbres semi-conducteurssemi-conducteurs, le siliciumsilicium et le germanium. L'enjeu est d'élargir leur champ d'utilisation et notamment en optoélectroniqueoptoélectronique, mariage de l'électronique, pour le traitement des données, et de l'optique, pour son transport. Ces semi-conducteurs restent en effet handicapés par leur incapacité à émettre de la lumièrelumière. Pourtant, certains matériaux semi-conducteurs (comme l'arséniure de galliumgallium ou le phosphure d'indiumindium) le font très bien quand on excite judicieusement les électronsélectrons de leurs atomes. En redescendant ensuite à des niveaux d'énergieénergie inférieurs, ces électrons émettent alors des photonsphotons. On parle de gapgap direct. Mais à ce jeu, germanium et silicium sont beaucoup moins efficaces car la désexcitation se fait en partie par dissipation d'énergie dans le réseau cristallinréseau cristallin. C'est le gap indirect. Voilà autant de photons en moins. Le rendement de luminescence est si exécrable que ces deux matériaux sont inaptes pour toutes les applicationsapplications où l'on veut convertir de l'énergie électrique en lumière, comme dans une diode laserdiode laser. Le germanium, de plus, ne peut travailler que dans une courte bande de fréquence en infrarougeinfrarouge (une propriété que l'on exploite d'ailleurs dans des détecteurs à infrarouge).
Les scientifiques ont donc trois solutions : remplacer dans les circuits électroniques silicium et germanium par de l'arséniure de gallium ou du phosphure d'indium (mais c'est trop cher et trop complexe), utiliser ces deux derniers dans de classiques circuits à silicium (mais la cohabitation est difficile) ou convertir le silicium ou le germanium aux bienfaits du gap direct.
Et la lumière fut
En réalisant une structure en clathrate, donc complètement différente de l'arrangement naturel, les chercheurs ont considérablement amélioré la réponse optique du semi-conducteur, qui devient capable d'émettre de la lumière. Au passage, de nouvelles propriétés sont attendues dans le domaine thermo-électrique et on obtient également un matériaumatériau beaucoup plus léger puisqu'il emprisonne un grand volume vide dans ses petites cages ne contenant aucune molécule hôte. Le clathrate mis au point par Arnold Guloy et ses collègues présente d'ailleurs la propriété rare d'être plus léger à l'état solideétat solide que le germanium liquideliquide, à la manière de la glace qui flotte sur l'eau.
Pour l'instant, cette découverte en est au stade du laboratoire. Mais elle devrait intéresser beaucoup de monde dans l'industrie de l'électronique. Les travaux à venir porteront notamment sur la possibilité de réaliser une structure équivalente avec du silicium. Pour Arnold Guloy, la réalisation de ce nouveau matériau « est similaire à la création du fullerènefullerène en 1985, pour laquelle les chercheurs ne voyaient pas à quoi il pourrait servir ».