au sommaire

La tablette Galaxy Tab, de Samsung, une petite journée d'autonomie en utilisation intensive, et donc une recharge nocturne obligatoire. Fera-t-on beaucoup mieux dans quelque temps ? © Samsung
Aujourd'hui dominantes dans les appareils mobiles, les batteries dites lithium-ion voient leurs performances stagner depuis quelques années. Or elles ne suffisent pas ! Elles sont trop grosses pour les mobiles, par exemple, et certains cherchent à en réduire l'épaisseur, jusqu'à les rendre imprimables voire incluses dans un vêtement. Au fil des ans, la baisse de consommation des circuits électroniques ne compense que peu ou pas du tout l'augmentation de puissance des smartphones, avec leurs écrans grandissants et leurs appareils photo sophistiqués.
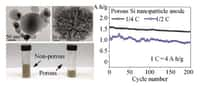
Une équipe de l'école McCormick (Northwestern University, Chicago, États-Unis) vient de montrer une voie pour améliorer drastiquement ces batteries au prix d'une modification somme toute mineure de l'anodeanode. Leur trouvaille, publiée dans la revue Advanced Energy Materials, multiplierait par dix la capacité. « Même après 150 recharges - ce qui correspond à une année d'utilisation -, notre batterie est encore cinq fois plus efficace que les modèles neufs du commerce » explique dans le communiqué Harold H. Kung, auteur principal de la publication. De plus, le temps de recharge, affirme l'équipe, descend à 15 minutes.
C'est dans l'intimité du fonctionnement de la batterie que réside l'innovation. Dans un modèle classique, l'anode (l'électrodeélectrode négative, donc le « - » de la batterie) est constitué de graphitegraphite, du carbonecarbone pur (la mine de nos crayons) où les atomesatomes sont organisés en plans - le graphènegraphène - empilés les uns sur les autres. Quand la batterie débite du courant, les ionsions lithiumlithium, via l'électrolyte, se déplacent de la cathodecathode (qui contient des oxydes de lithium) vers l'anode et s'y accrochent. L'un des facteurs qui déterminent la capacité d'une batterie à maintenir sa charge est la quantité d'ions lithium qui peuvent s'accumuler sur l'anode (et sur la cathode pendant la recharge).
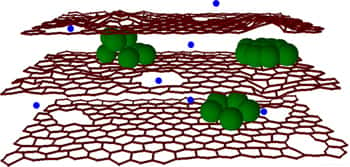
Entre les feuilles de graphène (en rouge) sont glissés des amas d'atomes de silicium (en vert). Des trous ouvrent le passage aux ions lithium (en bleu) dans l'épaisseur des couches. © McCormick School
Un peu de silicium dans l'anode
Les chimistes de McCormick ont conservé l'idée du graphite mais ont glissé entre les feuilles de graphène des amas de siliciumsilicium. Sur un plan de graphène, en effet, un atome de lithium se fixe sur un ensemble (hexagonal) de six atomes de carbone, et pas davantage. Or un seul atome de silicium peut retenir quatre atomes de lithium. L'équipe explique avoir essayé de remplacer le graphite par du silicium mais cela ne donne pas de bons résultats : l'anode se fragmente et se détériore rapidement. D'où l'idée des amas de silicium inclus entre les feuilles de graphène. Voilà donc la capacité augmentée.
Pour accélérer la recharge, les scientifiques ont perforé le graphène, par oxydationoxydation, pour percer les feuilles de trous de 10 à 20 nanomètresnanomètres de diamètre. En effet, lors de la charge, les ions lithium viennent se coller sur la surface de carbone, s'y fixent tout de suite, ou, quand toutes les places sont occupées, continuent leur chemin jusqu'au bord de la feuille et passent sur l'autre face pour tenter leur chance à l'étage inférieur, comme une voiturevoiture dans un parking souterrain. En leur proposant des trouées, on accélère la vitesse de leur pénétration dans l'épaisseur et donc la rapiditérapidité de la charge.
Si l'explication de la prouesse est relativement simple, les résultats quantitatifs sont étonnants. Multiplier par dix la capacité d'une batterie sans toucher au principe de son fonctionnement, ce n'est pas rien... Les difficultés d'industrialisation du procédé ne sont pas précisées : on est encore au laboratoire. D'ailleurs, ces chimistes affirment qu'ils n'ont pas dit leur dernier mot car ils veulent maintenant s'attaquer à la cathode, celle qui contient le lithium, et qui pourrait peut-être en stocker davantage, ou le lâcher plus facilement, ce qui augmenterait la capacité ou le débit. L'angoisse de la batterie vidée dans la journée disparaîtra-t-elle ?