Un éléphant, ça ne se brosse pas les dents ! Non, mais ça n’empêche pas la chimie de vouloir fabriquer du dentifrice à éléphant. Du moins, en apparence. Les explications en vidéo de Maëlle Mosser, docteur en chimie à l’ENS de Lyon.
au sommaire
Bien que l'éléphant ait des dents d'une taille impressionnante -- jusqu'à 2,5 kgkg pour une molairemolaire --, personne ne l'a sans doute jamais vu se servir d’un dentifrice. Alors qu'est-ce donc que cette expérience du dentifrice de l'éléphant ? Tout simplement une réaction chimique qui produit une moussemousse s'échappant de sa fiole comme un dentifrice sortirait d'un tube suffisamment grand pour brosser les dents d'un éléphant !
Pour reproduire l'expérience présentée dans la vidéo, il vous faudra réunir le matériel suivant :
- Grand cristallisoir en verre.
- Fiole jaugée de 1 L.
- Bécher de 50 mL.
- Spatule.
- Bouilloire (pour 10 mL d'eau chaude).
- Liquide vaisselle.
Ainsi que ces quelques produits dont certains sont à manipuler avec précaution :
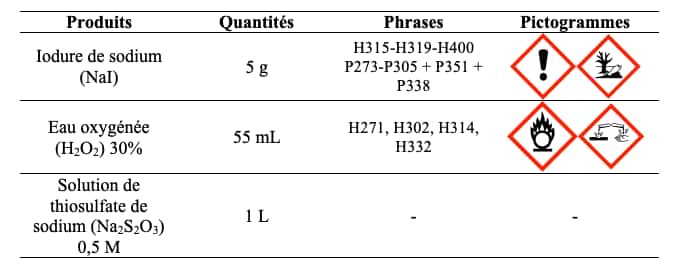
Le protocole à suivre ensuite est le suivant :
- Verser le liquide vaisselle dans la fiole jaugée (tache d'environ 3 cm de diamètre) et 55 mL d'eau oxygénéeeau oxygénée. Placer la fiole jaugée dans le grand cristallisoir.
- En parallèle, dans le bécher de 50 mL, dissoudre 5 g de NaI dans 10 mL d'eau. Bien agiter pour tout dissoudre.
- Ajouter le contenu du bécher dans la fiole jaugée et s'écarter.
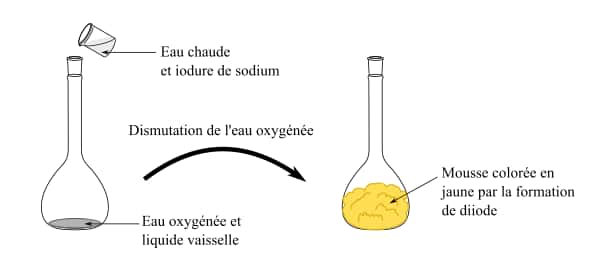
Que s’est-il passé ?
En milieu aqueuxaqueux, l'eau oxygénée n'est pas stable. Elle se dismute lentement pour former de l’eau et du dioxygène gazeux :
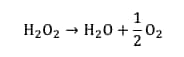
Cependant, cette réaction est lente. Pour l'accélérer, il est nécessaire de la catalyser. Dans cette expérience, la catalyse est réalisée par les ions iodure.
Quand l'eau oxygénée est mise en contact avec les ions iodure, il se produit une réaction d'oxydoréduction. La réaction se fait à pH 7, donc en regardant les potentiels apparents des couples mis en contact, on obtient le diagramme suivant :
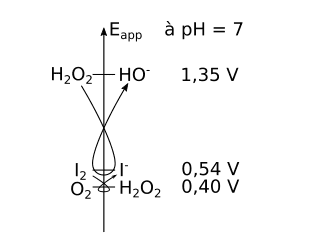
Les demi-équationséquations rédox mises en jeu sont donc :
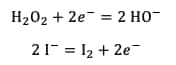
La réaction totale est la suivante :
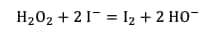
Il y a formation de diiode, ce qui est visible par la couleurcouleur jaune-brun qui apparaît immédiatement dans la fiole jaugée.
Le diiode formé peut lui-même réagir avec l'eau oxygénée en solution selon une autre réaction d'oxydoréduction dont les demi-équations des couples impliqués sont :
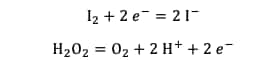
La réaction totale est la suivante :
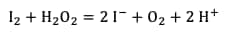
Il y a formation de dioxygène gazeux, ce qui provoque la formation de bulles dans le liquide vaisselle et donc la formation d'une mousse.
Pour aller plus loin
En complétant le diagramme de potentiel apparent, on constate que les ions iodures peuvent réagir pour donner d'autres espècesespèces rédox comme IOIO3- ou IO- :
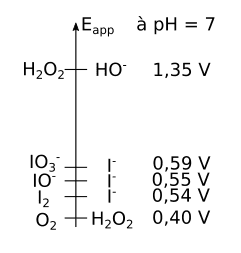
Vu la faible différence de potentiel apparent entre les différents couples des espèces iodées, toutes ces réactions se produisent probablement simultanément en solution.
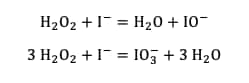
Cependant, chacune des espèces formées IO3- ou IO- peut réagir, elle aussi, selon une réaction d'oxydoréduction avec l'eau oxygénée pour donner du dioxygène :
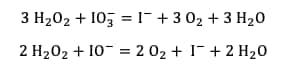
D'autres réactions peuvent également se produire au cours de cette expérience. En effet, lors de la réaction de H2O2 avec I- il peut y avoir production d'ions hydroxyde, ce qui basifie le milieu. Or, en milieu basique, I2 n'est pas stable et se dismute selon :
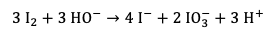
Les ions IO3- ou IO- formés par cette réaction peuvent à leur tour réagir avec l'eau oxygénée comme vu précédemment.
De plus, les ions hydroxydes sont eux-mêmes un catalyseurcatalyseur pour la réaction de dismutationdismutation de l'eau oxygénée :
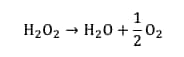
À la fin de la réaction, il reste du diiode qui n'a pas réagi avec l'eau oxygénée, il est donc nécessaire de le neutraliser avant de pouvoir jeter la solution aqueusesolution aqueuse. En effet le diiode présente une toxicitétoxicité pour l'homme et pour l'environnement. Pour cela, on utilise du thiosulfate de sodiumsodium. Celui-ci permet la réduction du diiode en ions iodures, moins toxiques pour l'environnement. Les deux demi-équations des couples impliqués sont :
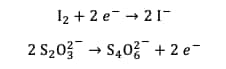
La réaction totale est la suivante :
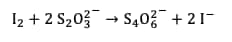
© Futura & ENS de Lyon









