au sommaire
- À lire aussi

Les noyaux
La matière est constituée d'atomes, le plus souvent assemblés en molécules ou en cristaux. Ces atomes sont très petits, de l'ordre du dix milliardième de mètre, et ils sont très nombreux : 6x1023 atomes par gramme d'hydrogène par exemple. Ils sont eux-mêmes formés d'un nuagenuage d'électrons au sein duquel est enfoui un noyau cent mille fois plus petit : si le nuage électronique avait la taille de la place de la ConcordeConcorde, le noyau aurait la taille d'un petit pois.

La place de la Concorde
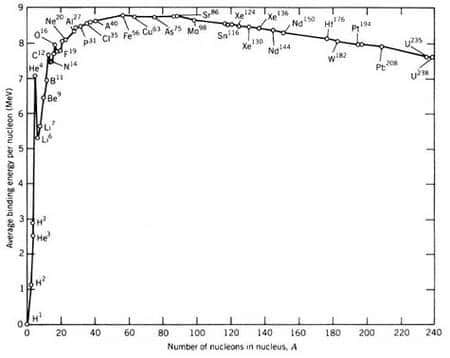
La taille du noyau est donc de l'ordre du femtomètre (un millionième de milliardième de mètre) que les physiciensphysiciens ont rebaptisé fermi (fm) en l'honneur d'Enrico FermiEnrico Fermi. À cette échelle, les énergiesénergies se mesurent en MeV (millions d'électron-voltsélectron-volts), unité mieux adaptée que le joulejoule. 1 MeV ne représente que 160 millionièmes de milliardièmes de joule, mais les atomes (et donc leurs noyaux) sont nombreux : si tous les noyaux d'un gramme d'hydrogène possèdent chacun une énergie de 1 MeV, ce gramme possède une énergie de 100 milliards de joules, soit 30 MWh, l'énergie de 2 tonnes de pétrolepétrole ou de 25 tonnes de TNT. On voit ainsi apparaître l'immense quantité d'énergie stockée dans les noyaux.
Le noyau est un assemblage de deux types de particules, les neutronsneutrons et les protonsprotons. Comme leur nom l'indique, les neutrons sont électriquement neutres et ils ont une massemasse de 939.6 MeV. Les protons sont un peu plus légers (938.3 MeV) et possèdent une charge électrique positive (égale à celle de l'électron mais de signe opposé). Le nombre d'électrons détermine les propriétés chimiques de l'atome : 6 électrons, c'est du carbonecarbone, 7 c'est de l'azoteazote. L'atome est neutre, et son noyau possède donc le même nombre Z de protons qu'il a d'électrons. Ce nombre Z définit l'identité chimique du noyau, c'est son numéro atomiquenuméro atomique : Z=6 pour le carbone, Z=7 pour l'azote. Changer le nombre N de neutrons ne modifie pas les propriétés chimiques du corps, mais cela change ses propriétés physiquesphysiques, et en particulier sa masse. Avec 8 neutrons le carbone est plus lourd qu'avec 6, et en plus il est instable et se transmute en azote. Des noyaux ayant le même nombre Z de protons mais un nombre de neutrons N différent sont appelés des isotopesisotopes. Formant les noyaux, protons et neutrons sont appelés des nucléonsnucléons, et le nombre total A = Z+N de nucléons est le nombre de massenombre de masse du noyau. On parle alors de carbone 12 (Z=6, N=6) noté 12C, de carbone 14 (Z=6, N=8) noté 14C ou d'uraniumuranium 238 (Z=92, N=146) noté 238U. On donne le nom d'isobaresisobares aux noyaux de même nombre de masse mais de numéro atomique différent comme l'argonargon 40, le potassiumpotassium 40 et le calciumcalcium 40.
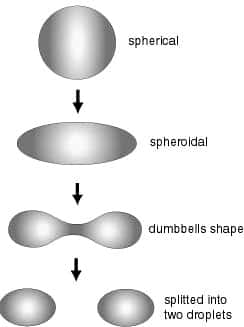
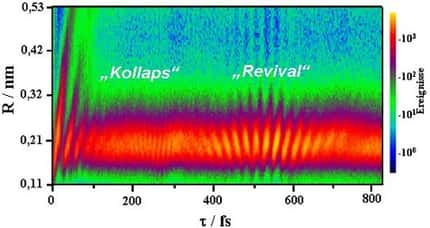
Les protons du noyau ayant tous la même charge électrique se repoussent, il doit donc y avoir une « colle » pour assurer la cohésion des noyaux. Avec beaucoup d'imagination, on l'a appelée la force nucléaire forte (ou interaction forteinteraction forte). Elle possède des caractéristiques étonnantes, outre son intensité : sa portée se limite à quelques fermis, elle est attractive au-delà de 1 fm, mais répulsive en deçà.
Représentation (très schématique) de la forme du potentiel nucléaire : répulsion intense à très courte distance, puis attraction diminuant exponentiellement avec la distance.
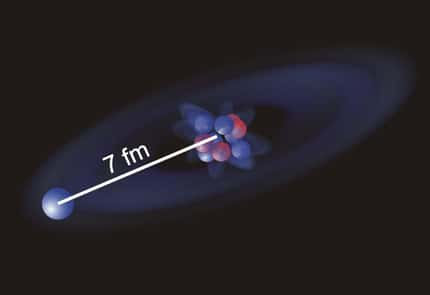
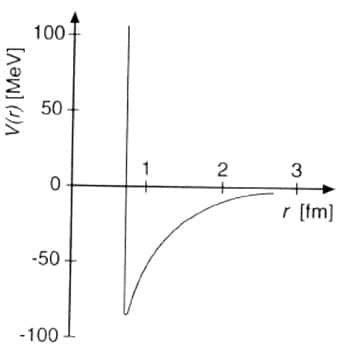
Les nucléons se collent ainsi les uns aux autres mais en gardant leurs distances : il y a saturation de la force nucléaire. Le volumevolume du noyau est ainsi proportionnel au nombre de nucléons, et son rayon est voisin de 1.2 A1/3 fm : les noyaux ont tous des tailles comparables (4 fm pour le calcium, 7 fm pour le plombplomb). Leur bord est cependant diffusdiffus et ils ressemblent plus des sacs où se promènent des boules de coton qu'à un empilement de boules de billard.
Rayons de quelques noyaux
La « colle » nucléaire assure la cohésion du noyau, ce qui signifie qu'il faut faire un effort pour séparer les nucléons et donc apporter de l'énergie au noyau. Inversement de l'énergie est libérée quand les nucléons se collent les uns aux autres. Cette énergie est l'énergie de liaison. La relation d'EinsteinEinstein E=mc2 implique que la masse du noyau est inférieure, de 1% environ, à la somme des masses de ses nucléons : ce défaut de masse a été mesuré pour les noyaux les plus stables par Francis Aston à partir de 1920.