Radioactivité, en savoir plus
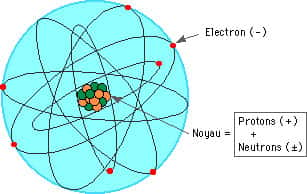
L'atome est composé d'un noyau (protons + neutrons) autour duquel gravitent les électrons. Toute la massemasse de l'atome est concentrée dans le noyau, les électrons ayant une masse négligeable.

Par définition:
masse atomique = noyau = nombre de protons (+) + nombre de neutrons (-)
numéro atomiquenuméro atomique = nombre de protons (+)
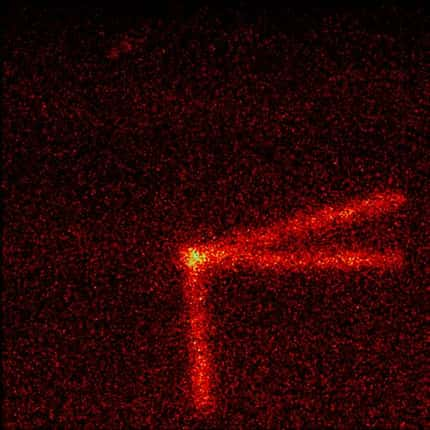
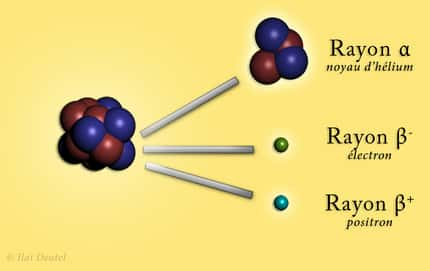
La radioactivitéradioactivité est due à l'instabilité du noyau qui se désintègre par émissionémission d'énergieénergie, principalement sous deux formes:
- particule α = 2 protons (+) + 2 neutrons (±) : d'où une perte de 4 dans la masse atomique et une perte de 2 dans le numéro atomique ;
- particule β = 1 électron (-) : cet électron vient du noyau ; il faut donc aller le chercher chez un neutron (±) qui alors devient un proton (+). Il y a donc gain d'un proton, d'où un gain de1 au numéro atomique, mais aucun changement de masse atomique, car l'électron a une masse négligeable.
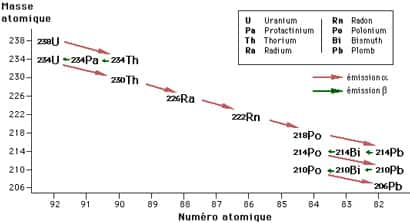
Un exemple : la désintégration de l'uranium 238 (238U) en plomb 206 (206Pb)
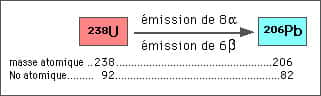
L'émission de 8 α entraîne la perte de 8 x (2 protons + 2 neutrons), ce qui signifie une perte de 32 à la masse atomique, ainsi que la perte de 8 x 2 protons qui signifie une perte de 16 au numéro atomique.
L'émission de 6 β entraîne la perte de 6 électrons, donc pas de changement à la masse atomique, mais un gain de 6 au numéro atomique.
Le bilan des gains et pertes s'établit donc ainsi :
masse atomique : 238 - 32 = 206
numéro atomique : 92 - 16 + 6 = 82 (numéro atomique du Pb)
La désintégration se fait par étapes successives, selon la suite :