au sommaire

Röntgenthérapie, curiethérapie, brachythérapie, téléradiothérapie
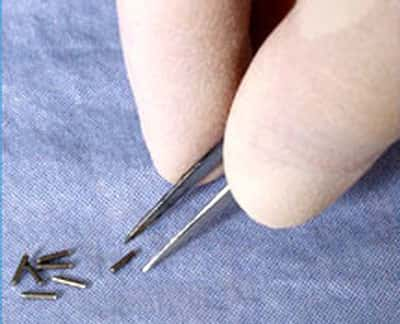
Les médecins avaient très vite compris que les rayonnements ionisants tuaient plus facilement les cellules cancéreuses que les cellules saines, bien qu'ils n'aient pas su pourquoi. Mais il y eut un long chemin à parcourir avant qu'ils ne parviennent à optimiser les doses de ces rayonnements tout en minimisant les risques pour les patients (et les opérateurs !). À l'âge héroïque, il n'était pas possible de calculer la dose de rayonnement émise (et encore moins la dose reçue), et les médecins recouraient le plus souvent à une irradiation massive aux rayons X d'une grande partie du corps pour détruire la tumeurtumeur d'un seul coup. Cela entraînait fréquemment la nécrose des tissus sains environnants sans garantir l'absence de récidiverécidive de la tumeur. Pour les tumeurs traitées par radioactivité, on employait des sels de radium, d'abord contenus dans des tubes en verre puis dans des aiguilles en platine, placés contre les tumeurs (ou à l'intérieur) ce qui limitait leur usage aux cancerscancers accessibles de l'extérieur et de petite taille (cancers du seincancers du sein, de la peau, du col de l'utéruscol de l'utérus). Le radium coûtant très cher, on a utilisait plutôt son descendant, le radonradon 222. Celui-ci est produit en continu par le radium, il se désintègre en quelques jours et des gammas apparaissent dans la transmutationtransmutation bêtabêta de son descendant le plombplomb 214. On recueillait le radon dans des tubes moins risqués à transporter que la source de radium.



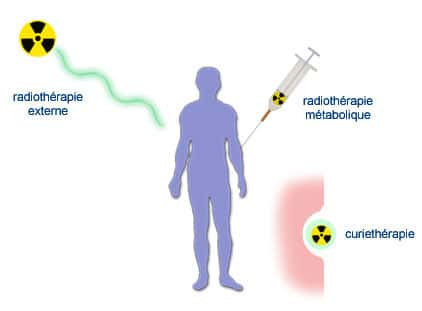
En France, les pionniers de la radiothérapieradiothérapie furent Claudius Regaud et Gustave Roussy. Regaud avait découvert la sensibilité particulière de certains organes aux rayonnements ionisants et avait appliqué ces observations au traitement du cancer. Avec ses collaborateurs, comme Antoine Lacassagne et Henri Coutard, il mit au point à l'Institut du Radium de Paris des matériels nouveaux et élabora des protocolesprotocoles de traitement pour choisir au mieux l'intensité, la duréedurée et la fréquencefréquence des irradiations. François Baclesse jeta en 1936 les bases du traitement conservateur du cancer du sein (une radiothérapie avant la chirurgiechirurgie permettait d'éviter l'ablationablation totale du sein). Jean Pierquin mit au point les aiguilles au radium, Lucien Mallez et Robert Collez les premières mesures dosimétriques. Les calculs de dose demeuraient empiriques, et utilisaient comme unité le milligramme de radium par heure, ce qui mesure l'activité de la source mais non la dose absorbée par les tissus (c'est toute la différence entre becquerelsbecquerels et graysgrays). Avec Simone Laborde, Gustave Roussy fut également un des pionniers de l'utilisation du radium en cancérologiecancérologie, d'abord en traitement de contact (curiethérapiecuriethérapie, radiothérapie de contact, radiothérapie interne ou brachythérapiebrachythérapie) puis en traitement à distance (radiothérapie externe ou téléradiothérapie) en mettant en place des « bombes » au radium. Les premières furent mises en service en 1929 malgré leur coût exorbitant (l'équivalent de plusieurs millions d'euros).

Leurs travaux conduisirent à fractionner les doses et à mettre au point des procédures standardisées pour permettre une étude fiable des relations entre doses reçues et effets biologiques. La meilleure dose pour traiter un cancer et la meilleure manière de délivrer cette dose faisait en effet l'objet de nombreuses études semi-empiriques. Hermann Wintz (1887-1947) et Guido Holzknecht (1872-1931) préconisaient par exemple de délivrer une dose aussi intense que possible dans le délai le plus court possible, tandis que Leopold Freund (1868-1943) et Claudius Regaud favorisaient le fractionnement des doses. Robert Kienböck (1871-1953) insista sur la nécessité de mesurer les doses délivrées. Les Suédois mirent au point le « système de Stockholm » dans lequel des doses de 30 à 90 mg de radium étaient appliquées pendant 24 h à 2 ou 3 reprises, espacées d'une semaine. Le « système de Paris » (premier du nom) employait initialement une seule applicationapplication de 60 mg de radium laissés 5 jours en place. À New York, Edith Quinby (1891-1982) fut l'une des premières à déterminer la distribution du rayonnement produit par les aiguilles de radium selon leur disposition, permettant de rechercher la disposition la plus efficace selon la tumeur à traiter. Elle compara aussi les effets des rayonnements bêta et gamma, et elle élabora en 1941 la première table de traitement reliant dose émise et dose reçue. Ses travaux conduisirent James Ralston Paterson (1897-1981) et Herbert Parker (1910-1984) à mettre au point à partir de 1934 le « système de Manchester » dans lequel la position des tubes de radon ou des aiguilles de radium était très précisément définie pour maximiser la dose reçue par la tumeur (en particulier celle du col de l'utérus) tout en minimisant la dose reçue par les cellules saines autour. Parker rejoignit ensuite les Etats-Unis où il dirigea la section médicale des laboratoires nucléaires d'Oak Ridge puis de Hanford, y mettant au point les doses admissibles de radioactivité et y définissant le rem (Röntgen equivalent man, ancêtre du sievert) à partir de la dose reçue (en rad, ancêtre du gray).

La radiothérapie devint une technique reconnue près le rapport de Henri Coutard (1876-1950) répertoriant les résultats positifs. La technique progressait également, les tubes à rayons X montant désormais à 200 kV permirent de traiter efficacement des cancers superficiels (le faisceau pénétrant jusqu'à quelques centimètres de profondeur). Les séances de radiothérapie demeuraient extrêmement longues et pénibles. Une solution fut d'augmenter la charge de radium des bombes (on atteignit 15 puis 50 grammes), ce que la baisse (modérée) du prix du radium rendit plus facile. La découverte de la radioactivité artificielle par Irène et Frédéric Joliot-CurieFrédéric Joliot-Curie en 1934 ouvrit de nouveaux horizons. Il devenait possible de fabriquer quasiment à la demande la source radioactive ayant l'intensité et l'énergieénergie voulue pour telle ou telle application. On put également choisir des éléments à courte durée de vie, disparaissant donc rapidement, ou des éléments ayant les propriétés biochimiques voulues pour s'installer d'eux-mêmes précisément à l'endroit voulu pour le traitement (radiothérapie métabolique). L'iridiumiridium 192 (bien plus facile à modeler en fils prenant la forme voulue) et le césiumcésium 137 remplacèrent le radium en radiothérapie de contact, et le cobaltcobalt 60 le remplaça dans les bombes à partir de 1951 (en France, la première fut installée en 1955 à l'Institut Gustave Roussy).


Une grande partie de ces développements se déroula d'ailleurs en France, en particulier à l'Institut Gustave-Roussy de Villejuif, sous l'impulsion de Maurice Tubiana et de Jean Dutreix pour la radiothérapie externe, d'Andrée Dutreix pour la dosimétrie, et de Bernard Pierquin pour la curiethérapie.
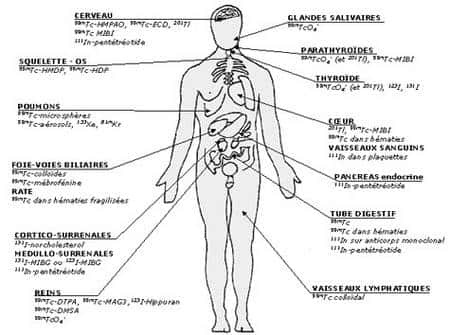
Maurice Tubiana y développa en particulier l'utilisation des isotopesisotopes radioactifs, comme l'injection d'iodeiode 131 pour le traitement du cancer de la thyroïdecancer de la thyroïde. Dans les années 1960, Bernard Pierquin et Andrée Dutreix développèrent le « système de Paris » (deuxième du nom) en fournissant des règles d'implantation rigoureuses de l'iridium 192 et une dosimétrie prévisionnelle permettant de déposer 60 grays dans le volumevolume de la tumeur en 3 à 10 jours d'irradiation continue (ou en deux ou trois fractions).
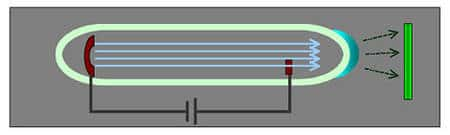
Les sources radioactives émettrices de rayons bêta se virent aussi remplacés à partir de 1952 par des accélérateurs d'électronsélectrons (les bêtatrons) permettant de régler avec précision le flux et l'énergie des rayons. Toutes ces sources plus intenses permirent de diminuer les durées de traitement et d'améliorer grandement les pronosticspronostics.
D'immenses progrès ont eu lieu au cours des dernières décennies grâce d'une part à une bien meilleure connaissance des effets biologiques des rayonnements et d'autre part grâce aux progrès techniques qu'ont représenté l'association de sources intenses, de l'imagerie en temps réelle (scanners, TEPTEP) et de l'utilisation d'ordinateursordinateurs tant pour effectuer les calculs de dosimétrie que pour piloter les sources. Mais ceci est une autre histoire...
N'oublions pas également le développement remarquable de l'utilisation de sources radioactives non pour traiter mais comme traceurs biologiques. L'ironie veut que le point de départpoint de départ ait été l'incapacité de George de Hevesy (1885-1966) à séparer chimiquement en 1911 le « radium-D » du plomb. À cette époque le réseau des chaînes de désintégration était très mal connu, et les produits de désintégration successifs du radium s'appelaient tout bêtement radium-A, radium-B, etc. Le radium-D est en fait du plomb, mais c'est l'isotope radioactif plomb 210 du plomb ordinaire (plomb 206 ou radium-G). Hevesy pensa alors que si le radium-D avait le même comportement chimique que le plomb, il aurait le même comportement biologique, et qu'il pourrait alors suivre le métabolismemétabolisme du plomb dans un organisme vivant en suivant le cheminement de la radioactivité.
C'était l'idée même des traceurs radioactifs. On dit qu'il l'utilisa en particulier pour suivre au fil des jours, dans la pension de famille où il résidait, la transformation du rôti en ragoût puis en hachis puis en soupe. La découverte de la radioactivité articifielle permit d'élargir considérablement la gamme des isotopes radioactifs utilisables, et leur utilisation va aujourd'hui de la médecine (diagnosticsdiagnostics et imagerie médicale) à la biologie, l'industrie et l'écologieécologie.