au sommaire
L'unité du vivant contemporain et son mode de fonctionnement cellulaire suggère que la vie est apparue sous les traits d'une cellule simplifiée : des automates cellulairesautomates cellulaires primitifs.

Comment s'est déroulée l'apparition des premières cellules ? Ici, une expérience de bioluminescence en laboratoire. © Live and Learn, Shutterstock
Pendant des décennies, les chimistes se sont évertués à reconstituer en laboratoire les molécules indispensables au fonctionnement d'une cellule contemporaine : les molécules de compartimentation, les molécules catalytiques et les molécules de l'information (plan de montage).
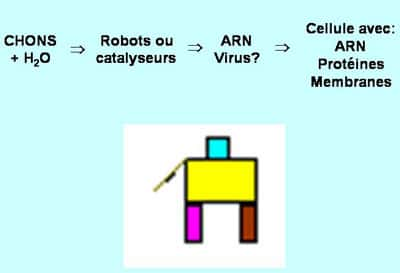
Les molécules catalytiques et molécules de l'information sont-elles à la base de la vie ? © DR
Les membranes primitives, formées de molécules amphiphiles
Les membranes assurent la cohésion de la cellule. Elles sont formées de molécules amphiphilesamphiphiles qui possèdent à la fois une tête polaire hydrophilehydrophile et des chaînes carbonées hydrophobeshydrophobes. Les acides grasacides gras forment des vésicules à condition que la chaîne hydrocarbonée renferme au moins dix atomes de carbone. Toutefois, les membranes produites à l'aide de ces composés amphiphiles simples ne sont stables que dans une gamme étroite de conditions expérimentales, de sorte que des composés chimiques plus complexes ont vraisemblablement été nécessaires pour conférer une bonne stabilité aux membranes primitives.
Les oligomères courts de l'isoprène représentent une piste intéressante. Leurs dérivés entrent dans la composition de certaines vitaminesvitamines (E, K1, par exemple), de la chlorophyllechlorophylle mais surtout dans celle des lipideslipides de certaines archaebactéries (halobacterium cutirubrum, par exemple). À Strasbourg, l'équipe du chimiste français Guy Ourisson (Ourisson et Nakatani, 1994) a obtenu des vésicules en fixant deux chaînes de diisoprène sur un groupe phosphategroupe phosphate.
L'analyse des météoritesmétéorites carbonées permit de détecter la présence d'acides gras à 8 atomes de carbone dans les extraits de la météorite de Murchison (Deamer, 1985). Certaines substances organiques extraites des chondriteschondrites carbonées de Murchison et d'Allende forment, en milieu aqueuxaqueux, des structures cloisonnées qui ressemblent à des membranes.
Les miniprotéines
Dans une cellule contemporaine, la copie de l'information chimique est assurée par des protéinesprotéines chimiquement actives, les enzymesenzymes. Les 20 acides α-aminés utilisés par les enzymes, de type NH2-CHR-COOH, comportent une fonction amine NH2 et une fonction acide COOH séparées par un seul atome de carbone. Ils diffèrent par la nature du substituant R. Celui-ci porteporte quelquefois une fonction chimiquement active, siège de l'activité catalytique. Les acides α-aminés ayant plusieurs atomes de carbone entre les fonctions amine et acide et les acides aminésacides aminés disubstitués qui ont deux substituants carbonés sur l'atome de carbone central ne sont pas utilisés.
Une chaîne peptidique se forme par élimination d'une molécule d'eau entre les fonctions amines et acides carboxyliquesacides carboxyliques des acides aminés. La chimiechimie des peptidespeptides offre toute une panoplie de réactions permettant de condenser les acides aminés dans les solvantssolvants organiques. Dans l'eau, le nombre de ces méthodes est beaucoup plus limité, surtout lorsque l'on ne retient que les réactions ayant pu être présentes sur la Terre primitive. Selon Christian de Duve (de Duve, 1998; de Duve, 2003), les premiers peptides furent formés via les thioesters qui permettent de générer des peptides courts en présence de surfaces minérales (Bertrand et al., 2001). Les dérivés activés des acides aminés les plus actifs dans l'eau sont probablement les N-carboxyanhydrides (Brack, 1982; Brack, 1987; Taillades et al., 1999).
La chaleurchaleur seule permet également de condenser les acides aminés. Des chercheurs japonais ont fait passer en circuit fermé une solution de glycineglycine et de chlorure de cuivrecuivre d'une chambre de réaction portée à 220 °C et 200 barsbars à une chambre maintenue à 0 °C et 200 bars pour mimer les conditions de trempe thermique qui règnent à proximité des sources chaudessources chaudes sous-marines. Ils ont pu ainsi polymériser la glycine jusqu'au stade de l'octamère (Imai et al., 1999 ; Ogata et al., 2000). À 220 °C en absence de trempe thermique, on n'observe que la décomposition chimique de l'acide aminé.
Dans notre équipe à Orléans (Brack, 1993), nous avons montré que l'eau, par ses propriétés chimiques, oriente la réaction de polymérisationpolymérisation et permet la sélection des acides aminés protéiques. Les protéines adoptent essentiellement deux géométries rigides, l'hélice α et les feuillets β. Les hélices α sont faciles à obtenir : il suffit de prendre un acide aminé hydrophile (soluble dans l'eau car ils portent une fonction ionisable sur la chaîne latérale) et un acide aminé hydrophobe (très peu soluble dans l'eau) et de les lier entre eux sans se préoccuper de l'ordre d'enchaînement. Lorsque les chaînes sont suffisamment longues, une vingtaine d'acides aminés environ, elles adoptent dans l'eau la conformationconformation en hélice α. Par contre, les polypeptidespolypeptides construits sur une alternance stricte d'acides aminés hydrophiles et hydrophobes adoptent tous une structure à feuillet β dans l'eau par agrégation des groupes hydrophobes (Brack et Orgel, 1975).
Lorsque l'on ajoute de l'alcoolalcool à l'eau, la force des interactions hydrophobes qui génère les feuillets β s'atténue et le polypeptide adopte alors une conformation hélicoïdale α. C'est donc l'eau qui, par ses propriétés physiquesphysiques spécifiques, permet la structuration en feuillets β. Les polypeptides à séquence alternée, capables de ce fait de prendre la géométrie β, présentent une bonne stabilité chimique. Dans les mêmes conditions expérimentales, les chaînes renfermant les mêmes acides aminés liés dans le désordre, sont dégradées beaucoup plus facilement. La dégradation est donc sélective. Elle a peut-être permis la sélection de séquences alternées, plus résistantes, contribuant ainsi à restreindre la complexité chimique au cours de l'évolution. La formation de feuillets β requiert l'utilisation d'acides aminés de même configuration, tous L ou tous D. Lorsque les séquences alternées renferment à la fois des énantiomèresénantiomères L et D distribués au hasard le long des chaînes, seuls les segments contenant au moins six acides aminés L (ou D) consécutifs s'agrègent en îlots β, optiquement purs (Brack, 1980). De nombreux peptides courts et certains polypeptides simples manifestent une activité catalytique, c'est-à-dire qu'ils sont capables d'accélérer certaines réactions chimiquesréactions chimiques. Par exemple, nous avons montré que les peptides basiques courts ne renfermant que deux acides aminés différents coupent les acides ribonucléiqueacides ribonucléique (Barbier et Brack, 1992).
Les mini-ARN
Les acides nucléiquesacides nucléiques actuels portent l'information génétiquegénétique qui permet la formation d'une cellule-fille identique à la cellule-mère. Ce sont des chaînes très longues constituées par la répétition de nucléotidesnucléotides. Chaque nucléotide se compose d'un sucresucre (riboseribose doté d'un groupe OH pour l'ARN, désoxyribosedésoxyribose pour l'ADNADN), d'une base (purinepurine A, G ou pyrimidine TT,U,C) et d'un groupe phosphate (Figure 2).
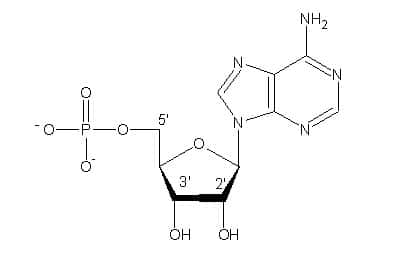
Figure 2. Chaque nucléotide se compose d’un groupe phosphate, d’un sucre et d’une base hétérocyclique. © DR
L'établissement de liaisons hydrogèneliaisons hydrogène permet l'appariement préférentiel des bases. Grâce à l'appariement des bases, l'ADN adopte une conformation stable en double hélice constituée par l'association tête-bêche de deux brins polynucléotidiques complémentaires. L'appariement des bases fournit également à l'ADN le moyen de transférer l'information qu'il porte imprimée dans sa séquence par un mécanisme d'autoréplication : les deux brins complémentaires se séparent et chacun d'eux sert de matrice pour la synthèse d'une nouvelle chaîne. La copie se fait avec une excellente précision puisque le taux d'erreur de traduction est de l'ordre d'un acide aminé sur dix mille.
La grande majorité des travaux de reconstitution en laboratoire d'acides nucléiques prébiotiquesprébiotiques porte sur les acides nucléiques à ribose (ARN) car ils sont considérés comme étant plus anciens, plus primitifs, que les ADN à désoxyribose. Le phosphorephosphore est présent dans les roches ignéesroches ignées terrestres sous forme de fluoroapatite (un fluorophosphate de calciumcalcium) qui représente 0,6 % de la massemasse minérale totale. La chloroapatite est le phosphate minéralminéral le plus abondant dans les météorites. La fluoroapatite n'est pratiquement pas soluble dans l'eau à pH 7 mais la solubilité peut être fortement augmentée par complexation avec un diacide comme, par exemple, l'acide oxalique. Les bases puriques sont obtenues facilement à partir de l'acide cyanhydriqueacide cyanhydrique, ou en soumettant un mélange gazeux de méthane, d'éthane et d'ammoniacammoniac à des décharges électriques. Toutefois, les rendements de synthèse sont très faibles. Les bases puriques et pyrimidiques sont présentes dans les météorites et peut-être dans les comètescomètes. La synthèse des sucres à partir de formaldéhydeformaldéhyde fournit un mélange très complexe dans lequel le sucre recherché est très minoritaire. La synthèse de nucléosidesnucléosides, association d'une base et du ribose, peut être réalisée par simple chauffage à l'état solideétat solide. Les rendements sont toutefois très faibles. De plus, la base se lie en plusieurs endroits du sucre, sans préférence marquée pour la liaison naturelle. La fixation du groupe phosphate au nucléoside peut également être obtenue par chauffage. Le groupe phosphate se fixe sur le ribose mais, là aussi, sans aucune spécificité.
La formation d'une chaîne d'acide nucléique requiert l'élimination d'une molécule d'eau entre le groupe phosphate et le sucre. Le chimiste américain James Ferris a découvert une argileargile qui catalysecatalyse efficacement la condensationcondensation des nucléotides (Ferris et al., 1996). La synthèse d'oligomères d'ARN est efficace en présence d'un brin d'ARN préformé qui sert de matrice. La réplicationréplication chimique, ou non-enzymatiqueenzymatique, a été étudiée avec succès par Leslie Orgel (Inoue et Orgel, 1982). Des brins préformés de poly C (un polyribonucléotide à pyrimidines) sont capables de sélectionner les nucléotides complémentaires G (à purines) pour former une double hélice grâce à l'appariement des bases G...C. La structure hélicoïdale aligne les nucléotides G le long de poly C et amène les groupes réactifsréactifs en contact ce qui leur permet de réagir. La réaction de condensation est très efficace et conduit à la formation de liaisons naturelles 3'-5'. La réaction est hautement spécifique car seul le nucléotide activé G complémentaire de la matrice poly C est incorporé. Si l'on présente à la matrice un cocktail de nucléotides, le nucléotide complémentaire est incorporé 100 à 500 fois plus efficacement. En l'absence de matrice, la condensation de G activé est très peu efficace et conduit à un mélange complexe de produits de petite taille. Il est aussi possible de transférer l'information de séquence de la matrice. La séquence matricielle C-C-G-C-C dirige la condensation d'un mélange de G et de C activés et fournit G-G-C-G-G préférentiellement aux autres séquences. Cependant, la synthèse sur matrice se heurte encore à un certain nombre de difficultés. Par exemple, dans les expériences de réplication chimique, la matrice est constituée de sucres D et les nucléotides activés sont également D. En alimentant la matrice D avec des nucléotides L, la condensation est peu efficace. En utilisant un mélange racémique renfermant autant de nucléotides D que de nucléotides L, on observe une inhibitioninhibition presque totale de la réaction car les nucléotides L empoisonnent la condensation des nucléotides D (Joyce et al., 1984). La réplication chimique ne se développe qu'avec des molécules déjà triées, situation peu plausible sur la Terre primitive.
Les chimistes ont alors cherché à exploiter des analogues des acides nucléiques biologiques. Des travaux remarquables menés par le chimiste suisse Albert Eschenmoser portant sur le rôle possible du phosphate de glycolaldéhyde dans l'évolution chimique montrent que ce composé conduit facilement en présence de formaldéhyde à un sucre ribopyranose, c'est-à-dire un cycle oxygéné à 6 atomes. Les travaux, en cours, ont déjà donné des résultats encourageants (Eschenmoser, 1999). La synthèse d'un analogue d'ARN construit sur la forme furanosyle du thréose (un tétrose) a également été décrite par le groupe d'Eschenmoser (Schöning et al. 2000). Les acides nucléiques peptides, synthétisés initialement par Nielsen et ses collaborateurs (Koppitz et al., 1998), comportent un squelette achiral de poly-2-aminoéthyl glycine. Cependant, la formation prébiotique d'ARN demeure encore inexpliquée.