au sommaire
L'avidine est une protéineprotéine tétramère présente dans le blanc d’œuf d'oiseaux, de reptilesreptiles et d'amphibiensamphibiens. Elle représente 0,05 % des protéines du blanc d'œuf, soit environ 180 μg par œuf. L'avidine est fortement glycosylée (environ 10 % de sa masse totale étant constituée de glucidesglucides), ce qui contribue à son point isoélectrique basique et à sa grande solubilité dans l'eau et les solutions salines aqueuses.
Le complexe avidine-biotine
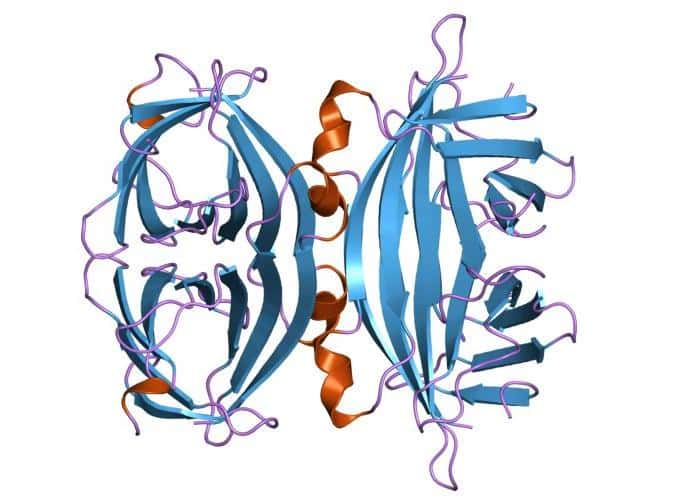
L'avidine a une affinité extrêmement forte à la biotinebiotine (vitaminevitamine H ou B7 ou coenzymecoenzyme R). C'est même la plus forte liaison non covalente connue entre une protéine et un ligand, avec une constante de dissociation de 1,7 x 1015 M. Cette affinité a d'ailleurs donné son nom à la protéine (avid en anglais + biotine). Une molécule d'avidine peut ainsi fixer jusqu'à quatre molécules de biotine. L'avidine empêche donc théoriquement l'assimilation de la biotine, présente elle dans le jaune d'œuf. Cependant, l'avidine est dégradée par la chaleur, ce qui lui fait perdre une grande partie de son affinité avec la biotine. Il faut donc éviter de manger des blancs d'œufs crus pour prévenir une carencecarence en vitamine B8vitamine B8.
Utilisation de l’avidine en biochimie
Le complexe avidine-biotine est utilisé dans de très nombreuses applications en pharmacie ou en biologie. L'interaction avidine-biotine est par exemple exploitée dans la détection, le marquage ou la purification des protéines, acides nucléiquesacides nucléiques et anticorpsanticorps. Comme le marqueur biotine est stable et petit, il interfère rarement avec la fonction des molécules marquées, ce qui permet le développement de tests robustes et très sensibles. La streptavidine, une version modifiée d'avidine purifiée à partir de la bactérie Streptomyces avidinii, est parfois préférée pour la détection, car elle possède un degré de liaison non spécifique plus facile en raison de l'absence de glycosylation.