au sommaire
Une réaction chimique est dite « réversibleréversible » lorsqu'elle peut se faire dans un sens (le sens direct) ou dans le sens inverse.
Chimie : réaction réversible et point d'équilibre
En d'autres mots, une réaction réversible est une réaction chimique au cours de laquelle les réactifs se transforment en produits, qui eux-mêmes réagissent ensuite pour reformer des réactifs. Une équation réversible a atteint son point d'équilibre lorsque les concentrations des réactifs et des produits ne changent plus.
Dans une équation chimique, une réaction réversible est notée à l'aide d'une double flèche.
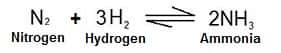
La réaction chimique qui forme de l’ammoniac à partir d’azote et d’hydrogène est une réaction réversible. © DR
La plupart des réactions chimiques sont irréversibles ou quasi-irréversibles tant la quantité de réactifs reformés à partir de produits est infime. À tel point que les chimistes ont longtemps pensé qu'il n'existait pas de réaction réversible. Jusqu'à l'observation par le chimiste français Claude-Louis Berthollet, en 1803, de la formation de cristaux de carbonate de sodium sur le bord d'un lac salé en Égypte.

La préparation du ciment repose sur une réaction réversible. © Pexels, Pixabay, DP
Exemples de réactions réversibles
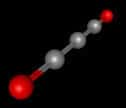
De manière générale, les solutions saturées ou les acidesacides et les bases faibles sont susceptibles de subir des réactions chimiques réversibles. Ainsi, l'acide carboniqueacide carbonique (H2CO3) -- présent, entre autres, dans les boissons gazeuses --, un acide faible, se produit-il, de manière réversible, à partir de deux réactifs que sont le dioxyde de carbonedioxyde de carbone (CO2) et l'eau (H2O).
Le procédé chimique dit « procédé de Haber » (qui sert à la synthèse de l'ammoniacammoniac) repose également sur une réaction réversible dans laquelle le diazote (N2) et le dihydrogène (H2) constituent les réactifs et l'ammoniac (avec quelques kilojoules d'énergieénergie), le produit.