au sommaire
Les éléments chimiques constituent les briques fondamentales de la matière, chacun ayant des propriétés distinctes. Définis par le nombre de protons dans leur noyau, ces éléments sont la base de la chimie moderne. Leur identification, leur mémorisation, et leur compréhension des interactions sont cruciales pour explorer les complexités du monde matériel qui nous entoure.
Qu'est-ce qu'un élément chimique ?
Un élément chimique est une substance pure composée d'atomes identiques, caractérisés par le nombre de protons dans leur noyau. Chaque élément possède des propriétés spécifiques, déterminées par sa configuration électronique. Un élément chimique est donc l'ensemble des entités - atomes ou ionsions - qui présente le même nombre Z de protons dans leur noyau. Nous connaissons aujourd'hui 118 éléments chimiques différents (des plus légers, comme l'hydrogènehydrogène, aux plus lourds, comme l'oganessonoganesson) dont 94 existant à l'état naturel sur Terre.
Ainsi, par exemple, le cuivrecuivre (Cu) et l'ion cuivre II (Cu 2+ ) sont deux entités de l'élément cuivre. Elles partagent les mêmes propriétés chimiques. Des entités différentes d'un même élément chimique peuvent avoir un nombre inégal de neutronsneutrons. On les appelle alors des isotopesisotopes.
Sous quelle forme se présentent les éléments chimiques ?
En général, la forme dans laquelle un élément se présente dépend de ses conditions environnementales, telles que la température et la pressionpression. Les éléments peuvent exister sous forme de gazgaz, de liquidesliquides, de solidessolides ou même de structures plus complexes, comme les cristaux.
À l'échelle macroscopique, ils peuvent exister sous forme de substances simples, comme l'oxygèneoxygène gazeux (O2), l'hydrogène gazeux (H2), ou le ferfer solide (Fe). À l'échelle microscopique, les éléments se présentent sous forme d'atomes. Les atomes sont les unités fondamentales de la matière et sont composés de noyaux chargés positivement, constitués de protons et de neutrons, entourés d'électronsélectrons chargés négativement. Certains éléments se trouvent naturellement sous forme moléculaire, comme l'hydrogène diatomique (H2) ou l'azoteazote diatomique (N2), où deux atomes du même élément sont liés ensemble.

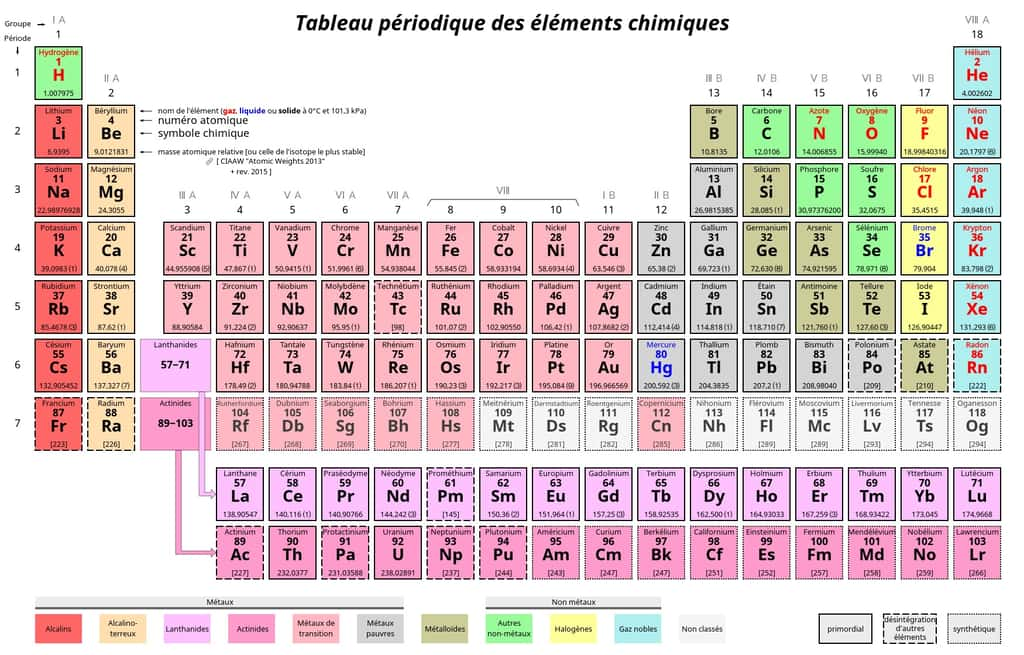
Identification des éléments chimiques : le tableau périodique
Les éléments chimiques sont désignés par des noms uniques et des symboles. La nomenclature chimique définit les règles pour attribuer ces symboles et noms, garantissant une uniformité mondiale dans la communication scientifique. Ils sont répertoriés dans le tableau périodique.
Il est généralement divisé en 18 colonnes, appelées groupes ou familles. Ces familles partagent des caractéristiques chimiques similaires en raison du nombre d'électrons dans leur couche de valencevalence. Voici quelques-unes des familles les plus couramment mentionnées dans le tableau périodique :
- Alcalins (groupe 1) : comprend des éléments tels que le lithiumlithium (Li), le sodiumsodium (Na), et le potassiumpotassium (K). Ils sont très réactifsréactifs, en particulier avec l'eau, et forment des hydroxydes alcalins lorsqu'ils réagissent avec des bases.
- Alcalino-terreux (groupe 2) : inclut des éléments tels que le magnésiummagnésium (Mg), le calciumcalcium (Ca), et le strontiumstrontium (Sr). Ils sont également réactifs mais moins que les alcalins.
- HalogènesHalogènes (groupe 17) : comprend des éléments tels que le fluorfluor (F), le chlorechlore (Cl), le bromebrome (Br), et l'iodeiode (I). Ce sont des non-métauxmétaux très réactifs.
- Gaz nobles (groupe 18) : inclut l'héliumhélium (He), le néonnéon (Ne), l'argonargon (Ar), le kryptonkrypton (Kr), le xénonxénon (Xe), et le radonradon (Rn). Ils sont caractérisés par leur stabilité chimique due à une configuration électronique complète.
- Métaux de transition : ces éléments occupent les blocs d, f dans le tableau périodiquetableau périodique. Ils comprennent des métaux tels que le fer (Fe), le cuivre (Cu), et le zinczinc (Zn).
- LanthanidesLanthanides (série des terres raresterres rares) : comprend les éléments du lanthanelanthane (La) au lutéciumlutécium (Lu). Ils occupent le bloc f.
- ActinidesActinides : comprend les éléments de l'actiniumactinium (Ac) au lawrenciumlawrencium (Lr). Ils occupent également le bloc f et sont connus pour leur instabilité et leur radioactivitéradioactivité.
- Métaux pauvres (ou métalloïdes) : Bien que ce ne soit pas une famille spécifique, les métaux pauvres, tels que le siliciumsilicium (Si), le germaniumgermanium (Ge), et le telluretellure (Te), partagent des propriétés intermédiaires entre les métaux et les non-métaux.
Les familles peuvent également être désignées par des numéros, notamment les groupes 1 à 18, avec les groupes principaux et les blocs s, p, d, et f dans le tableau périodique.
Astuces mnémotechniques pour retenir les éléments chimiques
Retenir la multitude d'éléments du tableau périodique peut être un défi, mais des moyens mnémotechniques peuvent simplifier le processus.
Par exemple, dans cette phrase : « Harry, Le Bébé Boit du Café, Nous Observons Notre Grande Table », la première lettre des mots correspond aux symboles des éléments suivants : H (Hydrogène), He (Hélium), Li (Lithium), Be (BérylliumBéryllium), B (BoreBore), C (CarboneCarbone), N (Azote), O (Oxygène), F (Fluor), Ne (Néon), c'est-à-dire l'ordre des sept premiers éléments : Hélium, Lithium, Béryllium, Bore, Carbone, Azote, Oxygène, Néon, Magnésium, AluminiumAluminium, et ainsi de suite.
Nombre atomique et nombre de masse
Le nombre atomique, égal au nombre de protons, différencie chaque élément. Le nombre de massenombre de masse, somme des protons et neutrons, indique la masse totale de l'atome. Ces valeurs sont cruciales pour l'identification précise des éléments.
L’isotope, variante de l’élément chimique
Un isotope est une variante d'un élément chimique qui a le même nombre de protons mais un nombre différent de neutrons dans son noyau. Les isotopes d'un élément ont des propriétés chimiques similaires en raison du nombre identique de protons, mais ils peuvent différer en masse en raison du nombre variable de neutrons.
Pour déterminer si un élément est un isotope, il faut connaître le nombre de protons et de neutrons présents dans le noyau de l'atome en question. Les éléments sont définis par leur nombre de protons, appelé le nombre atomique, qui est représenté par la lettre Z dans la notation symbolique d'un élément (par exemple, l'hydrogène a un nombre atomique de 1, noté H).
Le nombre de masse d'un isotope, représenté par la lettre A dans la notation symbolique, est la somme du nombre de protons (Z) et du nombre de neutrons (N). Ainsi, A = Z + N. Si deux atomes ont le même nombre de protons (Z), mais des nombres de masse différents (A), alors ils sont des isotopes du même élément.
Par exemple, l'hydrogène a trois isotopes naturels : l'hydrogène ordinaire (protium, ^1H), le deutérium (^2H), et le tritiumtritium (^3H). Les trois isotopes ont un seul proton, mais le nombre de neutrons varie.
Réactions entre les éléments chimiques
Les réactions chimiquesréactions chimiques résultent de l'interaction entre les éléments. Ces processus, régis par les lois fondamentales de la chimie, engendrent la formation de nouveaux composés en redistribuant les électrons entre les atomes participants. Un élément chimique ne peut se transformer en un autre élément chimique que s'il subit une réaction nucléaireréaction nucléaire de transmutationtransmutation. C'est d'ailleurs à partir de réactions nucléaires successives que s'est créé, au cœur des étoilesétoiles, l'ensemble des éléments chimiques.
Éléments chimiques les plus abondants sur terre
L'abondance des éléments sur Terre varie, mais l'oxygène, le silicium, l'aluminium, le fer, le calcium, le sodium, et le potassium dominent la composition. Ces éléments jouent des rôles essentiels dans la formation des minérauxminéraux, des roches et de la biosphèrebiosphère.
















