au sommaire
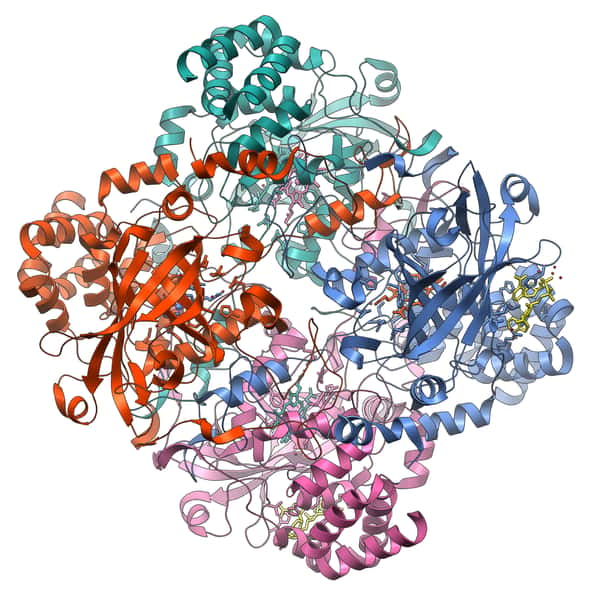
La catalase est une enzyme à quatre sous-unités. © Vossman, Wikimedia, CC by-sa 3.0
La catalase est une enzyme qui permet la dismutation du peroxyde d'hydrogène (eau oxygénée) en eau et dioxygène.
Structure de la catalase
Les catalases sont retrouvées chez tous les organismes aérobies, dans les peroxysomes des eucaryotes. Ce sont des enzymes formées de quatre chaînes peptidiques, chacune composée de plus de 500 acides aminés. Elles contiennent des atomes de Fer au sein de hèmes, qui constituent les sites actifs de la protéine.
Fonction de la catalase
La liaison oxygène-oxygène du peroxyde d'hydrogèneperoxyde d'hydrogène est coupée par l'atome de fer du groupement hèmehème, en créant une molécule d'eau et une liaison fer-oxygène très oxydante. Celle-ci peut oxyder une nouvelle moléculemolécule de peroxyde d'hydrogène, donnant du dioxygène. La réaction enzymatique en jeu est l'une des plus rapides connues.
Au sein de la cellule, la catalase permet de protéger l'organisme de l'action oxydante et néfaste du peroxyde d'hydrogène.
Importance biologique de la catalase
La catalase joue un rôle crucial dans la protection cellulaire contre les dommages oxydatifs causés par les espècesespèces réactives de l'oxygène (ROS). Cette enzyme est d'une importance vitale pour la survie des organismes aérobiesaérobies, permettant une adaptation efficace aux conditions riches en oxygène qui prédominent dans l'atmosphèreatmosphère terrestre.
En transformant rapidement le péroxyde d'hydrogène en eau et en oxygène, la catalase aide à maintenir l'équilibre redox intracellulaire et à éviter l'accumulation de péroxyde d'hydrogène qui pourrait autrement entraîner des dommages importants aux lipideslipides, protéinesprotéines et acides nucléiquesacides nucléiques via des réactions de peroxydation et d'oxydationoxydation.
Diversité et adaptation
Les catalases montrent une grande diversité dans leurs séquences d'acides aminésacides aminés et structures tridimensionnelles, reflétant une adaptation évolutive à divers environnements et conditions métaboliques. Par exemple, les catalases bactériennes peuvent différer considérablement de celles trouvées chez les eucaryoteseucaryotes, soulignant l'importance de cette enzyme dans divers contextes biologiques.
Réactions chimiques facilitées par la catalase
La catalase n'accélère pas seulement la décomposition du peroxyde d'hydrogène; elle peut également catalyser l'oxydation de divers réducteurs organiques comme l'éthanol, le formaldéhydeformaldéhyde et le phénol. Cette polyvalence contribue à la grande utilité de l'enzyme tant dans les processus biologiques que dans les applicationsapplications industrielles et biotechnologiques.
Cette capacité à catalyser différentes réactions la rend également un outil précieux dans la recherche scientifique, où des études sur la catalase ont contribué à notre compréhension de la réaction oxydative et de la protection contre le stress oxydatifstress oxydatif en biologie.
Applications pratiques de la catalase
Outre son rôle biologique, la catalase est largement utilisée dans l'industrie alimentaire pour éliminer le peroxyde d'hydrogène des emballages alimentaires et dans le traitement des eaux uséeseaux usées pour briser les contaminants oxydants. De plus, elle est employée dans l'industrie textile pour protéger les tissus lors du blanchiment.
Dans le domaine de la recherche médicale, il est exploré l'utilisation de la catalase comme traitement potentiel pour certaines maladies liées au stress oxydatif, telles que la maladie d'Alzheimermaladie d'Alzheimer et le diabètediabète. Des études préliminaires suggèrent que l'augmentation de l'activité catalasique pourrait offrir une protection contre le vieillissement et la dysfonction cellulaire.
La catalase ne se contente pas de décomposer le peroxyde d'hydrogène; elle joue un rôle essentiel dans la protection contre les dommages oxydatifs, avec des implications significatives pour la santé humaine et de nombreuses applications industrielles.
Pour plus de détails scientifiques sur la catalase et ses études, référez-vous à des publications disponibles sur des bases de donnéesbases de données scientifiques comme PubMed, accessible via ce lien.