au sommaire
Voisin du radon dans le tableau périodique des élémentstableau périodique des éléments, l'astate est l'halogène le plus lourd connu à ce jour.
Généralités
- Symbole : At
- Numéro atomique : 85
- Électrons par niveau d'énergie : 2, 8, 18, 32, 18, 7
- MasseMasse atomique : 210 u
- IsotopesIsotopes les plus stables : 210At avec une demi-viedemi-vie de 8,1 heures (100 %)
- Série : halogènes, métalloïdes
- Groupe, période, bloc : 17 (VIIA), 6, p
- Densité : entre 6,2 et 6,5
- Point de fusionfusion : 302 °C
- Point d'ébullition : 337 °C
Historique de l’astate
L'astate 211 a été synthétisé en 1940 par Corson, MacKenzie et Segrè par bombardement du bismuthbismuth 209 en utilisant des particules alpha. Son nom provient du grec astatos, qui signifie « instable ».
Propriétés de l’astate
On sait assez peu de choses au sujet de l'astate. Sa couleurcouleur, par exemple, n'est pas connue avec certitude : une quantité macroscopique d'astate solidesolide se vaporiserait instantanément à cause de l'importante chaleurchaleur générée par sa radioactivitéradioactivité. On ne peut que conjecturer qu'il est plus sombre que l'iodeiode, suivant en cela la tendance des halogènes à mesure qu'augmente le nombre de protonsprotons. Chimiquement, il se comporte comme les autres halogènes, en particulier l'iode. On ne connaît pas sa structure cristalline et l'existence d'astate diatomique est débattue.
Utilisation de l’astate
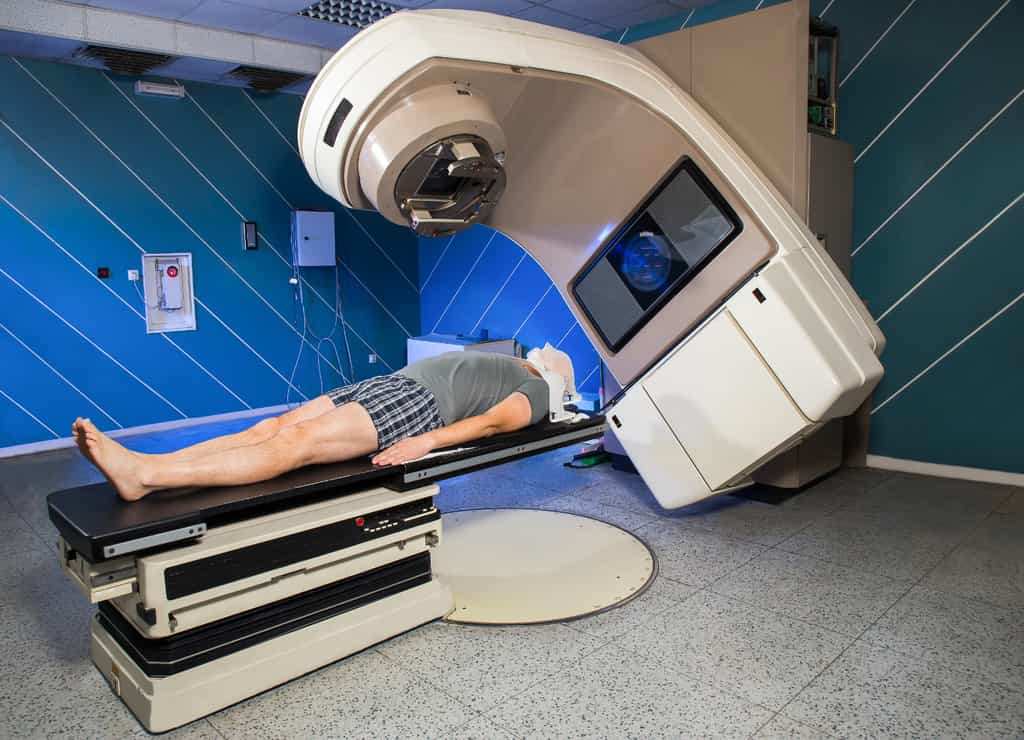
En médecine nucléaire, l'astate 211 a de nombreuses applicationsapplications comme émetteur de particules alpha pour la radiothérapieradiothérapie malgré sa demi-vie de seulement 7,2 heures.
L'astate, l'élément naturel le plus rare sur Terre
L'astate est considéré comme l'élément naturel le plus rare sur Terre. Les scientifiques estiment que la croûte terrestrecroûte terrestre en possède moins de 30 grammes...