au sommaire
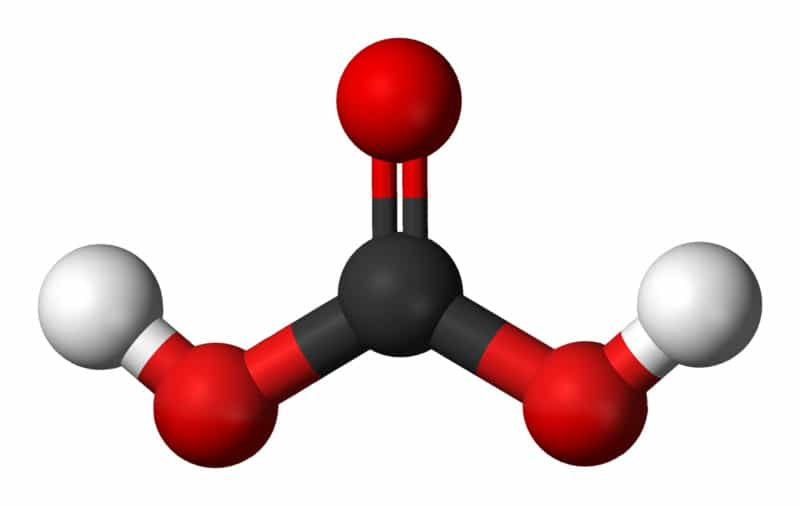
L'acide carbonique est un composé chimique de formule H₂CO₃.
Il se forme spontanément par dissolution (solvatation) lors de la dilution du gaz carbonique (CO₂) dans de l'eau. Cette molécule est dite diacide car elle peut se dissocier deux fois de suite en solution aqueuse et donc donner des anions bicarbonate (HCO₃⁻) puis carbonate (CO₃²⁻). Un proton H⁺ est libéré lors de chaque transformation.
Acide carbonique et acidification des océans
Les rejets massifs de CO₂ dans l'atmosphère par diverses activités anthropiques provoquent depuis quelques années une acidification des océans. Ce phénomène est principalement dû au fait que l'acide carbonique, produit en plus grande quantité, est instable. Il donne son protonproton avec une grande facilité lorsqu'il se transforme en ion bicarbonate (sa base conjuguée), provoquant alors une élévation du pH dans le milieu.
Ce phénomène participe à la dégradation des récifs et des coquilles de mollusques en dissolvant le carbonate de calcium synthétisé par ces organismes.
Propriétés chimiques de l'acide carbonique
L'acide carbonique est intéressant non seulement pour son impact environnemental, mais aussi pour ses propriétés chimiques. Lorsqu'il se forme en solution aqueuse, l'acide carbonique interagit avec l'eau pour donner des ionsions hydronium (H3O⁺) et bicarbonate. Ce réarrangement moléculaire est essentielle pour comprendre le comportement du CO₂ dans des conditions d'équilibre aqueuxaqueux.
Stabilité et décomposition
En solution, l'acide carbonique n'est pas une entité particulièrement stable. Il se décompose rapidement en dioxyde de carbonedioxyde de carbone et en eau, suivant la réaction inverse de sa formation. Cette décomposition est accélérée par la température et la concentration en ions qui peut conduire à la formation de bicarbonate et de carbonate à des taux plus élevés, comme c'est le cas dans les océans.
Rôle biologique de l'acide carbonique
L'acide carbonique joue un rôle clé dans de nombreux processus biologiques. Il est essentiel dans la régulation du pH dans le sang des vertébrésvertébrés par le système tampon bicarbonate. Cette capacité à maintenir le pH du sang dans une gamme étroite est vitale pour le fonctionnement correct de divers processus métaboliques et la stabilité enzymatiqueenzymatique.
Applications industrielles et environnementales
En dehors de son rôle biologique, l'acide carbonique trouve des applicationsapplications dans diverses industries. Par exemple, il est utilisé dans les boissons gazeuses pour procurer leur pétillant caractéristique. Le CO₂ dissous sous forme d'acide carbonique est également utilisé dans les procédés de récupération améliorée du pétrolepétrole, où il aide à extraire plus efficacement le pétrole des réservoirs souterrains.
Dans le domaine environnemental, l'understanding des interactions entre l'acide carbonique et divers contaminants peut aider à développer des stratégies plus efficaces pour la gestion des écosystèmesécosystèmes aquatiques et la remédiation de sites pollués.