La sélection naturelle est le mécanisme permettant aux populations de s'adapter de façon continue à leur environnement. Mais pour qu'une population s'adapte, cela suppose qu'il existe une variabilité génétique entre les individus.
au sommaire

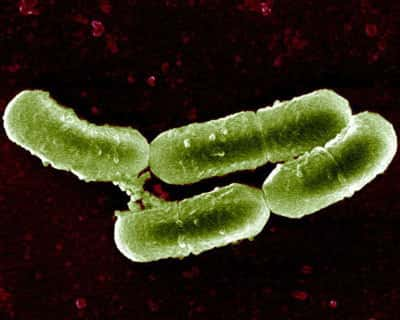
© Université d'Ottawa / R. KassenLes chercheurs ont criblé les bactéries résistantes à un antibiotique
Or le mécanisme permettant de créer une variabilité d'un individu à l'autre sont les mutations génétiquesgénétiques. Si l'on sait que c'est sur la base de ces mutations que s'opère le tri de la sélection naturellesélection naturelle, il reste difficile de les caractériser car elles sont essentiellement dues à des évènements rares : des erreurs lors de la réplicationréplication de l'ADNADN d'un organisme d'une génération à l'autre. Les mutations avantageuses notamment sont les plus mal connues : on ne sait rien de leur fréquence ni de leurs effets. Et elles sont probablement plus rares que celles dites neutres ou défavorables, qui ont un effet négatif sur la survie de l'individu.
Prévoir l'évolution d'une population bactérienne
Les chercheurs de l'INRA et de l'université d'Ottawa ont mis au point le premier protocoleprotocole expérimental qui permet d'isoler un grand nombre de mutations favorables et de mesurer leur effet sélectif. Le modèle utilisé par les chercheurs est PseudomonasPseudomonas fluorescens, une bactériebactérie présente dans de nombreux milieux (sols, eaux, végétaux).
En criblant, par des méthodes d'évolution expérimentale, plus de 650 mutations touchant des gènesgènes conférant une résistancerésistance à un antibiotiqueantibiotique, ils ont ainsi estimé la fréquence moyenne d'apparition de mutants favorables et les effets de ces mutations sur la valeur sélectivevaleur sélective des individus.
Ils ont conclu que la plupart des mutations favorables confèrent un avantage sélectif faible et que seules quelques rares mutations confèrent des gains de valeur sélective plus substantiels. Les chercheurs ont ainsi confirmé la théorie établie par Fisher, J.H. Gillespie et A.H. Orr, qui prédit la distribution des effets des mutations favorables. Les chercheurs ont également retrouvé cette distribution en considérant les mêmes mutations et leurs avantages sélectifs dans 4 environnements différents (composition différente en sucressucres des milieux de culture).
Ces résultats suggèrent qu'il est désormais possible de faire une prédiction probabiliste de la trajectoire évolutive d'une population bactérienne rencontrant un nouvel environnement et de prédire quel gain de valeur sélective attendre des mutations dans ce nouvel environnement.
Des perspectives en agriculture et en santé animale
Au-delà de la biologie de l'évolution, cette modélisation peut avoir des applications notamment dans le domaine de l'agricultureagriculture pour prévoir les résistances des populations de ravageurs aux produits phytosanitairesproduits phytosanitaires utilisés pour les éradiquer.
Dans le domaine de la santé animale ou humaine également, elle peut aider dans la conception d'antibiotiques ou d'antivirauxantiviraux en prédisant les résistances des bactéries ou des virus pathogènespathogènes.