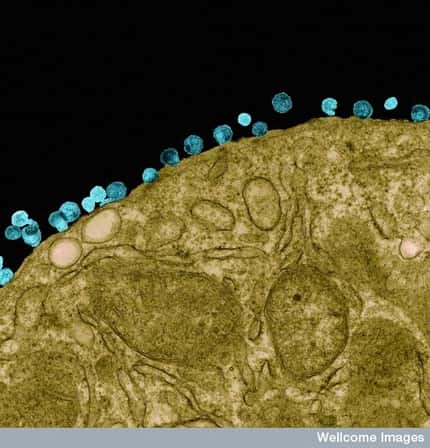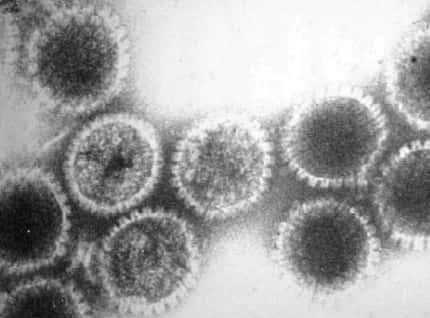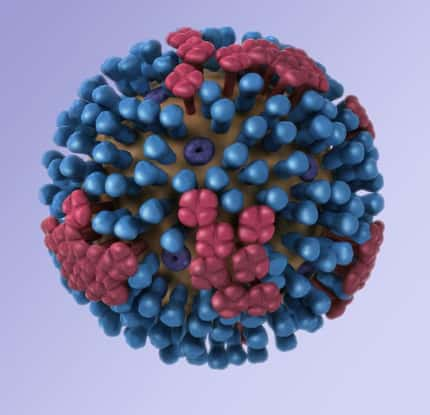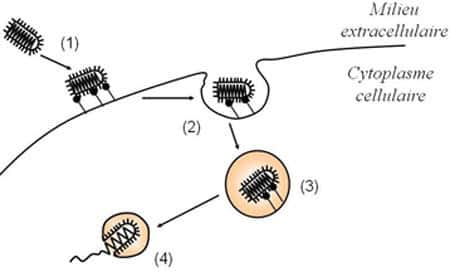
Entrée du virus de la stomatite vésiculeuse dans la cellule hôte. (1) Fixation du virus à la membrane cellulaire : la glycoprotéine G reconnaît un récepteur à la surface de la cellule (2) Endocytose du virus (3) La fusion, qui permet la libération de l'in
Les virus sont des parasitesparasites absolus. Pour se répliquer, ils doivent impérativement libérer leur génome à l'intérieur d'une cellule hôte. L'expression des gènesgènes viraux est alors assurée par la machinerie cellulaire qui est détournée de ses fonctions habituelles au profit exclusif du parasite. La membrane cellulairemembrane cellulaire constitue une barrière physique que les virus doivent être capables de franchir pour transférer leur génome à l'intérieur de la cellule. Certains virus dits enveloppés, tels ceux de la grippegrippe, du SIDASIDA, de la ragerage ou de l'hépatite Chépatite C, possèdent également une membrane. En conséquence, l'entrée de leur matériel génétiquematériel génétique passe par une étape dite de fusion entre l'enveloppe virale et la membrane cellulaire. Cette fonction est assurée par des protéinesprotéines membranaires spécifiques.
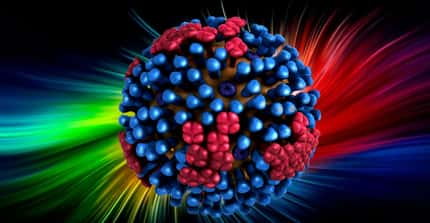
Le laboratoire de Virologie moléculaire et structurale (CNRS-INRA), vient de déterminer la structure atomique de la protéine Gprotéine G, protéine de fusion du virus de la stomatite vésiculeuse (VSV). Le VSV, qui cause parfois des épizootiesépizooties chez le bétail, appartient à la même famille que le virus de la rage. Les chercheurs ont observé que l'organisation de G possède des motifs caractéristiques des deux grandes classes de protéines de fusion identifiées à ce jour : le mécanisme de rapprochement entre le peptide de fusion et la structure transmembranaire est très semblable à celui de la "classe 1" (rencontrée chez le virus de la grippevirus de la grippe et les rétrovirusrétrovirus comme celui responsable du SIDA), et le domaine impliqué dans l'attaque de la membrane cellulaire ressemble à celui de la "classe 2" (trouvée chez les virus de la Denguevirus de la Dengue et de l'hépatite C). Ces convergences laissent penser que le nombre de solutions offertes à la nature pour fabriquer ces mécanismes d'infection est limité. Par conséquent, les stratégies thérapeutiques permettant de bloquer cette étape essentielle du cycle infectieux pour une famille virale devraient pouvoir être adaptées aux autres familles.
Simultanément, une équipe américaine menée par Stephen Harrison (Université d'Harvard) a déterminé la structure de la protéine de fusion (gB) du virus de l'herpèsherpès simplexsimplex de type I (HSV I) ou herpès labial, agent responsable du fameux "bouton de fièvrefièvre". La comparaison des protéines de fusion de HSV I et de VSV révèle qu'elles sont organisées de façon identique et donc qu'elles possèdent un ancêtre communancêtre commun. Ce résultat est surprenant car les virus des herpes et le VSV ne sont pas de la même famille. La nature même de leur génome est différente : ADNADN pour les premiers, ARNARN pour le second. Comment, dans ces conditions, peut-on expliquer l'origine commune des deux protéines de fusion ? Les modes de réplicationréplication et la nature des génomes ont indiqué que l'ancêtre du VSV (qui est aussi celui du virus de la rage) avait probablement dérobé le gène de la protéine de fusion de l'ancêtre du virus de l'herpès. Cette découverte a des conséquences importantes en termes d'évolution virale : elle montre que les virus à ARN peuvent aussi acquérir leurs gènes en les volant à la cellule hôte ou à un autre virus lors d'une co-infection. Ceci implique que les échanges de gènes entre virus mais aussi entre virus et cellule infectée sont sans doute des événements beaucoup plus fréquents qu'on ne le pensait et qu'ils concernent tous les virus quelle que soit la nature de leur génome et leur mode de réplication.
Contacts :
Chercheur
Yves Gaudin
TT 01 69 82 38 37
Yves.Gaudin@vms.cnrs-gif.fr
Presse
Isabelle Bauthian
T 01 44 96 46 06
isabelle.bauthian@cnrs-dir.fr