au sommaire
- À lire aussi
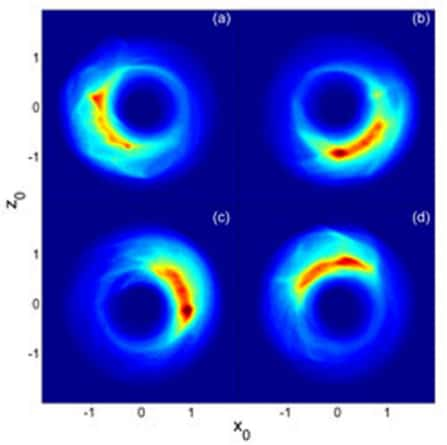
Le mouvement d'un électron dans un atome de potassium excité sur une orbite haute (atome de Rydberg). Crédit : Rice University
Lorsque Niels BohrNiels Bohr a introduit son modèle atomique en 1913, en effectuant une synthèse entre le modèle planétaire de l'atome de Rutherford et les idées quantiques de PlanckPlanck et EinsteinEinstein sur le caractère discontinu des échanges d'énergie entre matière et lumière, il savait déjà que la notion de trajectoire pour un électron en orbiteorbite autour du noyau était problématique.
Un électron en mouvementmouvement sur une orbite accélère et, ce faisant, doit rayonner de l'énergie et finir par s'écraser sur le noyau. C'est une conséquence inévitable de la théorie des électrons de Maxwell-Lorentz. En introduisant la quantificationquantification de l'énergie pour les orbites possibles d'un électron dans un atome d'hydrogènehydrogène, Bohr expliquait tout à la fois sa stabilité et les raies spectralesraies spectrales données par la formule de Balmerformule de Balmer et la constante de Rydberg.
Toutefois, les sauts quantiques entre différentes orbites qui s'accompagnaient d'une émissionémission ou d'une absorptionabsorption d'énergie ne pouvaient pas être conçus comme des transitions continues entre deux orbites suivies de l'échange d'un quantum de lumière. Non, tout se passait comme si l'électron disparaissait brutalement d'une de ses orbites pour se re-matérialiser sur un autre. Bohr était conscient de la difficulté et savait qu'il faudrait revoir les notions de localisation dans l'espace et le temps pour un objet comme l'électron dans le monde des atomes, même si l'on observe nettement sa trajectoire dans une chambre à brouillard ou, plus tard, à bulles.
Les progrès de la théorie quantique dans les années qui suivirent ne firent que rendre plus problématique encore les mélanges de concepts classiques et quantiques à mesure que l'on explorait le monde atomique. Au début des années 1920, Bohr introduisit son fameux principe de correspondanceprincipe de correspondance qui jetait un pont entre les formules classiques et les formules quantiques lorsque l'on considérait les détails de l'interaction matière-lumière dans les systèmes atomiques et moléculaires.

Niels Bohr (1885 - 1962). Crédit : AJ Software & Multimedia
En tant que mentor du jeune Heisenberg, il joua un rôle décisif dans le rejet final par ce dernier de toute trajectoire pour un électron dans le monde atomique et l'utilisation de matrices pour décrire la cinématique et la dynamique de l'atome, en remplacement des outils de l'analyse infinitésimale classique. C'est ainsi que naquit la mécanique matricielle en 1925, non sans faire intervenir aussi dans l'esprit d'Heisenberg des concepts issus des travaux d'Einstein en théorie de la relativité restreinterelativité restreinte et surtout de son article de 1917 où il posait les fondement du laserlaser et le premier faisait usage des probabilités dans le monde quantique.
Peu de temps après, Schrödinger publiait sa fameuse équationéquation basée sur l'idée mise en avant en 1923 par Louis de BroglieLouis de Broglie du caractère ondulatoire de la matière. Le mouvement d'un électron pouvait alors se comprendre en partie comme celui d'un paquetpaquet d'onde parfois localisable sur une trajectoire.
En fait, si l'on admet avec Bohr que les énergies d'un électron sur son orbite sont données par l'inverse du carré d'un nombre entier, la différence d'énergie entre deux orbites caractérisées par de grande valeurs de ces nombres entier tend vers zéro lorsque les nombres entiers tendent vers l'infini. On retrouve alors un semblant de variation continue pour les énergies échangées par un atome avec le champ électromagnétiquechamp électromagnétique et la notion de trajectoire d'un électron prend alors à nouveau du sens.
Dans cette situation, l'atome est fortement excité, sur le point d'être ionisé, et la taille de l'orbite de l'électron se rapproche des échelles de grandeurs du monde qui nous entoure : on parle d'atome de Rydbergatome de Rydberg. Grâce à leur taille, ces curieux objets sont très utiles pour explorer la transition du monde quantique au monde classique.
Une équipe de physiciensphysiciens menée par Barry Dunning de l'Université de Rice a pu créer un atome de Rydberg particulièrement impressionnant puisque grâce à une série de champs électriqueschamps électriques pulsés créés par un rayon laser, ils ont tellement excité un atome de potassiumpotassium que la notion classique d'orbite d'un électron est devenue presque une réalité. Sur la couche la plus externe, la taille de l'orbite est en effet de presque un millimètre!
Sur la vidéo, on a représenté l'évolution du paquet de probabilité associé à l'électron sur son orbite. La hauteur mesure l'importance de la probabilité de trouver l'électron en un point précis de l'espace et l'on voit nettement que l'on retrouve presque la notion de trajectoire classique.