Parfois, lorsque de l'eau liquide est refroidie, elle reste liquide alors qu'elle passe en-dessous de son point de cristallisation : on parle alors de surfusion de l'eau. Des chercheurs ont modélisé de l'eau dans cet état inhabituel, et ont découvert qu'en lui attribuant deux phases liquides différentes, elle reproduit les propriétés thermodynamiques qu'on lui connait.
au sommaire
À pression atmosphériquepression atmosphérique, si la température descend sous 0 °C, l'eau passe de l'état liquideétat liquide à l'état solideétat solide. Ou du moins, dans la plupart des cas. Parfois, si le refroidissement est fait dans des conditions particulièrement stables, l'eau demeure liquide, bien que la température soit sous son point de cristallisation. C'est ce qu'on appelle la surfusion. Cet état de la matière, pas seulement propre à l'eau, est métastablemétastable : il peut perdurer tant qu'aucun apport d'énergie ne perturbe le système, et le fasse passer dans son état le plus stable, l'état solide.
L'expérience peut d'ailleurs être faite à la maison : en mettant une bouteille d'eau en congélateur, si ce dernier ne vibre pas trop, l'eau sera en surfusion après quelques heures. Il suffit ensuite de transmettre un léger choc à la bouteille, et toute l'eau qu'elle contient se solidifie à vue d'œilœil !
Bien connu, quoique encore peu compris, le phénomène de surfusion est pris en compte dans divers domaines, notamment celui de l'aviation. Lorsque la température est légèrement en-dessous de 0 °C, si un avion pénètre dans un nuagenuage, ce dernier peut contenir quelques gouttes en surfusion. Mais dès qu'elles entrent en contact avec l'avion, elles se solidifient et peuvent alors le recouvrir de givre en seulement quelques secondes. Les avions doivent donc posséder un système de dégivrage pour pallier ce risque. Une nouvelle étude publiée dans Nature Physics s'est penchée sur les propriétés thermodynamiques de l'eau en surfusion, et en particulier sur sa structure moléculaire.
This water turning to ice as soon as it’s poured
— Science girl (@gunsnrosesgirl3) April 30, 2022
This is supercooled water, water that remains a liquid below its freezing point
Normally, imperfections in water such as dust particles, act as nuclei for crystal structures to grow around 1/????pic.twitter.com/OgK3Oz50ju
Deux phases liquides différentes
Les chercheurs ont pour cela réutilisé une théorie établie en 1992, qui suppose une coexistence de deux phases liquides différentes dans de l'eau surfondue. Plusieurs études dans ce sens ont montré que, théoriquement, un point critique liquide-liquide était possible en-dessous de zéro degré. Mais cette fois, l'équipe a utilisé des simulations pour modéliser les deux phases à l'échelle microscopique, afin d'étudier les caractéristiques, à la fois de chacune, mais aussi du mélange.
Ils distinguent une phase d'eau dite à « haute densité », et une autre à « basse densité ». Chacune possède un réseau tétraédrique initial, mais un arrangement différent de ces tétraèdres : la première est composée d'au moins deux tétraèdres enchevêtrés, tandis que la première consiste en un simple tétraèdre.
Le tout peut se modéliser comme de l'eau « colloïdale », c'est-à-dire de l'eau contenant des colloïdes, des substances (ici, de l'eau à haute densité) en suspension dans l'eau suffisamment grosses pour modifier le liquide à grande échelle, mais suffisamment bien réparties pour que le tout soit homogène. « Ce modèle colloïdal d'eau fournit une loupe dans l'eau moléculaire et nous permet de percer les secrets de l'eau concernant l'histoire de deux liquides », a déclaré Dwaipayan Chakrabarti coauteur de l'étude et chercheur à l'Université de Birmingham.
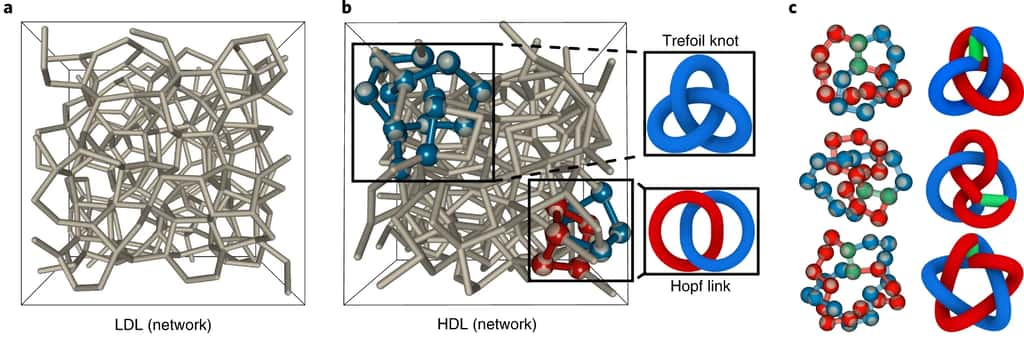
Les propriétés thermodynamiques de l'eau surfondue ont bien été reproduites par le modèle
Grâce aux simulations, les chercheurs sont parvenus à reproduire les propriétés macroscopiques de l'eau en surfusion, comme ils l'expliquent dans leur étude : « Ce modèle d'eau colloïdale capture le comportement thermodynamique anormal de l'eau surfondue, y compris le maximum de densité bien connu, et affiche deux phases liquides de réseau structurellement différentes ».
En effet, la transition liquide-liquide établie par les chercheurs se produit seulement pour une pression suffisamment haute, comme expliqué dans l'étude. « La transition se produit à des températures basses auxquelles le système a tendance à former un réseau liquide avec le nombre maximum de liaisons possible. Aux basses pressions, il est bien établi que cela est réalisé en formant un réseau tétraédrique aléatoire ouvert. »
Ils ont aussi montré que ces deux phases étaient instables : les liaisons se rompent et se reproduisent constamment. « Contrairement aux nœuds et aux liens formés par des chaînes ou des réseaux liés de manière covalente, les phases liquides à basse densité et haute densité sont des réseaux transitoires (c'est-à-dire que les liaisons se rompent et se forment constamment) et que leur état topologique n'est donc pas constant. Malgré cette évolution, les signatures topologiques de chaque phase sont bien définies. »
Comme cette coexistence de phases est très dure à étudier expérimentalement du fait du caractère métastable de l'eau en surfusion (y plonger un appareil de mesure reviendrait à changer l'eau en glace, par exemple), les chercheurs se réjouissent de la capacité des simulations. « Dans ce travail, nous proposons, pour la première fois, une vision de la transition de phasetransition de phase liquide-liquide basée sur des idées d'intricationintrication de réseau. Je suis sûr que ce travail inspirera une nouvelle modélisationmodélisation théorique basée sur des concepts topologiques », s'est enthousiasmé Francesco Sciortino, coauteur de l'étude, et qui a participé à l'élaboration de la théorie des deux phases liquides en 1992.