Une enzyme modifiée et protégée par la capsidecapside d'un virus bactérien, c'est le biomatériau que des chercheurs américains de l'université de l’Indiana (États-Unis) ont imaginé pour optimiser la production d’hydrogène par électrolyse de l'eau. Selon l'étude qu'ils viennent de publier dans la revue Nature Chemistry, cette nouvelle forme de catalyseur serait 150 fois plus efficace que la forme classique. Des travaux qui pourraient se révéler d'une importance majeure dans le cadre de la production économique de carburants propres et bons marchés pour les véhicules du futur.
Si les méthodes de production de l’hydrogène intéressent tant les chercheurs, c'est que cet élément pourrait permettre le développement d'une mobilité propre à base de véhicules à hydrogène. Ces derniers, en effet, consomment de l'hydrogène pour produire de l'électricité (et de l'eau) via des piles à combustible. Les techniques classiques qui consistent à produire de l'hydrogène par électrolyse de l'eau nécessitent l'usage de catalyseurs à base de métauxmétaux nobles, chers et rares, tels que le platine. Elles sont donc difficile à déployer à grande échelle.
L'une des solutions alternatives envisagées, depuis quelques années déjà, est le recours à des enzymes nommées hydrogénases. Ces enzymes catalysent de façon réversibleréversible la conversion d'ionsions H+ en dihydrogène H2. Elles restent toutefois délicates à synthétiser et manipuler car elles sont très sensibles aux autres produits chimiques qui peuvent être présents dans l'environnement et résistent difficilement aux températures ambiantes.
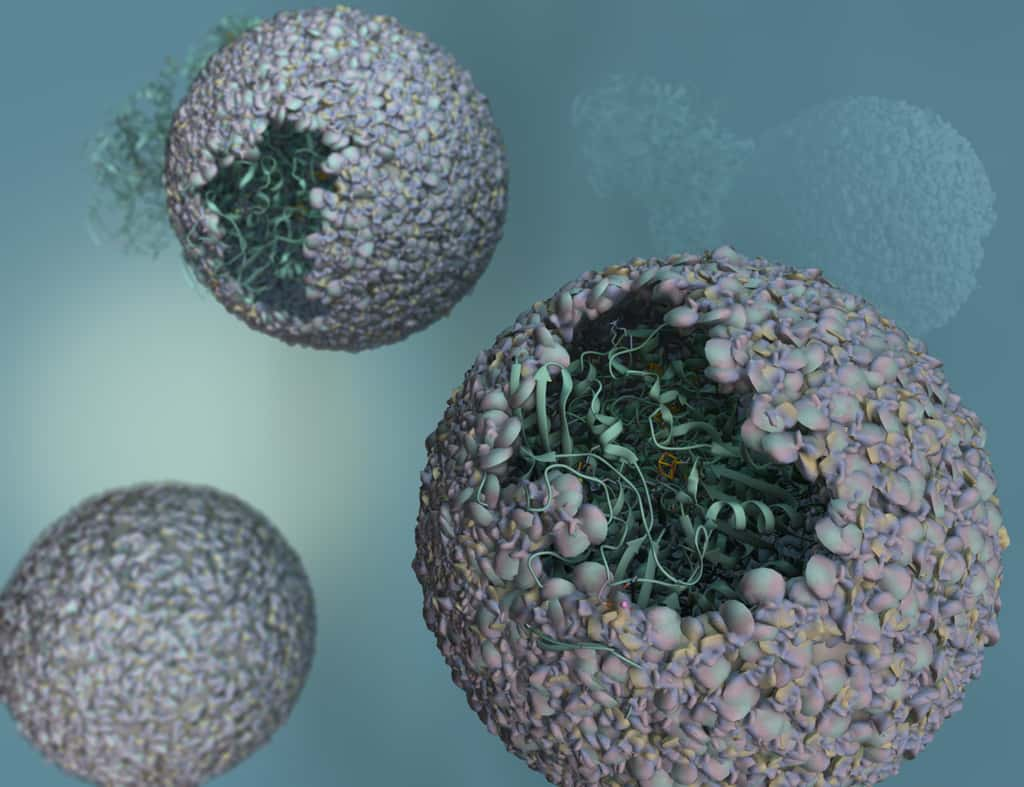
Sur cette vue d’artiste du biomatériau mis au point par des chimistes de l’université de l’Indiana (États-Unis), on distingue bien les enzymes prises au piège dans la capside d’un virus bactérien. © Trevor Douglas, University of Indiana
Une enzyme encapsulée dans un virus
Pour mener à bien leurs études, les chercheurs de l'université de l'Indiana ont choisi de travailler avec des hydrogénases dites [NiFe], les hydrogénases les plus répandues et les mieux connues. S'ils les ont choisies, c'est avant tout pour leurs capacités d'intégration au cœur de biomatériaux et pour leur tolérance à l'oxygèneoxygène.
L'idée des chimistes américains était de mettre à profit un procédé, développé par ailleurs, pour encapsuler dans un virus ces enzymes capables de « digérer des protonsprotons pour recracher de l'hydrogène sous forme de gazgaz ». Des enzymes particulièrement actives mais tout aussi fragiles et qui se trouvent ainsi efficacement protégées.
Ces hydrogénases sont directement produites au cœur de la capside, à partir des gènesgènes hyaA et hyaB de la bactérie Escherichia coli insérés au préalable dans la capsule. La capside, quant à elle, est celle du virus bactérien connu sous le nom de bactériophagebactériophage P22. Ce biomatériau innovant - et biodégradablebiodégradable, ce qui ne gâche rien - s'avère non seulement plus efficace que les hydrogénases classiques mais il peut également être produit à température ambiante, et donc, sans surcoût, par un simple processus de fermentationfermentation. De quoi remplacer très avantageusement les catalyseurs métalliques et encore plus si, comme l'espèrent les chercheurs de l'université de l'Indiana, ils réussissent à intégrer ce matériaumatériau dans un système à énergie solaire, de façon à initier la réaction d'électrolyse de l'eau sans apport supplémentaire d'électricité.