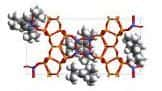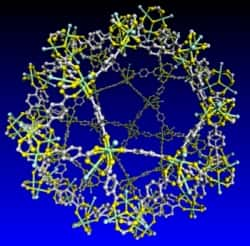
A petite échelle, le MIL-101 forme de larges cages de 35 angströms de diamètre, reliées entre elles par des pores de 20 angströms. © Gérard Férey/Institut Lavoisier UMR 8637 (CNRS, UVSQ)
Sans augmenter de volume, un mètre cube de cette poudre, retient... 400 mètres cubes de gaz carbonique, ou dioxyde carbone (CO2). Le MIL-101, c'est son nom, est un matériau poreux, dont les molécules s'agencent pour former des cages de 35 angströms de diamètre, dans lesquelles viennent s'emprisonner les molécules de gaz. La performance constitue le record du genre.
Ce résultat n'a rien de fortuit. Depuis longtemps, les solidessolides poreux, dont il existe une variété naturelle, la zéolithezéolithe, focalisent l'intérêt des laboratoires. Dans un volume faible, ils offrent dans leurs cavités microscopiques une surface phénoménale sur laquelle peuvent se fixer, par adsorptionadsorption, toutes sortes de molécules, y compris des gaz. Ils facilitent ainsi les réactions chimiquesréactions chimiques et s'utilisent comme catalyseurscatalyseurs dans de nombreux domaines, par exemple en pétrochimie. On aimerait également les utiliser pour capter des gaz, notamment l'hydrogènehydrogène, en alternative au stockage sous forme liquideliquide ou sous pressionpression, ou pour le dioxyde de carbonedioxyde de carbone. Dans cette voie, l'Institut Lavoisier (Université de Versailles-Saint-Quentin-en-Yvelines, UVSQ) a pris une longueur d'avance, sous l'impulsion de son fondateur, le chimiste Gérard Férey (membre de l'Académie des sciences), spécialisé dans ces solides poreux.
Ce laboratoire a synthétisé une série de matériaux basés sur des réseaux organométalliques, les MOF (Metal-Organic Frameworks). Baptisés MIL (Matériau de l'Institut Lavoisier), et repérés par un numéro, ils utilisent différents métauxmétaux, associés par des molécules organiques (comme l'acideacide téréphtalique, ou téréphtalate). Le MIL-53, par exemple s'est révélé un excellent candidat pour le stockage de l'hydrogène, surtout grâce à sa forte capacité obtenue à température ambiante. Sa structure ménage des cavités en forme de tunnels dans lesquelles peuvent s'engager les molécules d'hydrogène. L'entreprise allemande BASF le commercialise aujourd'hui sous le nom de Basolite, avec trois métaux (aluminiumaluminium, cuivrecuivre ou zinczinc).
© Gérard Férey/Institut Lavoisier UMR 8637 (CNRS, UVSQ)
Le gaz carbonique en cage
La vedette du jour s'appelle MIL-101, constituée de téréphtalate de chromechrome. Les molécules s'agencent en octaèdres qui eux-mêmes s'organisent en une superstructure tétraédrique. Le tout forme des cages de 35 angströms de diamètre reliées par des pores de 20 angströms. Les molécules de dioxyde de carbone - plus volumineuses que celles d'hydrogène - peuvent pénétrer à l'intérieur, cheminer dans ce labyrinthe et rester stables à l'intérieur des cages.
Ce beau résultat, fruit de longues années de recherche, vient d'être présenté à l'Académie des sciences. Il laisse envisager des applicationsapplications importantes, par exemple, pour piéger de grandes quantités de CO2, évitant de le relarguer dans l'atmosphèreatmosphère. Ce pourrait être le cas dans des installations produisant de l'hydrogène à partir de la biomassebiomasse. Il en est d'autres dans plusieurs domaines. Du gaz carbonique très pur pourrait ainsi être obtenu. L'industrie chimique pourrait profiter de ce principe apportant de fortes capacités d'adsorption, un avantage propre à limiter le nombre d'étapes dans des processus de synthèse. Des matériaux poreux du même genre pourraient servir à la décontamination, pour capter le gaz carbonique, le méthane, le sulfure d'hydrogènesulfure d'hydrogène ou d'autres impuretés.
Mais ces applications possibles restent pour l'instant du domaine de la spéculation et, comme toujours, il faudra un nombre respectable d'années pour passer du laboratoire (le stade actuel) à l'utilisation à l'échelle industrielle...