au sommaire

Comme toutes les réactions chimiques, celles qui provoquent des explosions sont les lieux d’échanges d’énergie dont les mécanismes fondamentaux restaient jusque-là mystérieux. © KINO, Flickr, CC by-nc-nd 2.0
En 1981, le professeur Roald Hoffmann a reçu le prix Nobel de chimie pour ses travaux sur le cours des réactions chimiques. Sera-t-il à nouveau gratifié de la récompense suprême pour les études qu'il vient de publier avec son collègue de l'université de Cornell (États-Unis), le docteur Martin Rahm ? Seul l'avenir nous le dira. En tout cas, leurs travaux explorent d'une manière totalement inédite - et quantique -, l'une des questions fondamentales de la chimie : comment fonctionne une réaction chimique ?
Il est traditionnellement admis que toutes les interactions entre molécules, atomes et électrons peuvent être interprétées comme des échanges d'énergieénergie. Mais les origines de cette énergie et les lois qui gouvernent les échanges d'énergie au cours des réactions chimiques restent difficiles à cerner.
La répartition de l’énergie de réaction
Avant tout, rappelons ce qu'il se passe lorsque deux atomes sont poussés l'un vers l'autre. En premier lieu, la répulsion entre leurs noyaux augmente. Leurs électrons sont alors mobilisés pour contrebalancer une partie de cette force de répulsion. Ils se concentrent dans une zone située entre les deux noyaux. L'énergie moyenne de liaison est ainsi modifiée du fait de l'attraction entre noyaux et électrons. Mais, en se rapprochant, les électrons interagissent aussi plus fortement les uns avec les autres.
En conclusion de leurs études, le docteur Martin Rahm et le professeur Roald Hoffmann suggèrent qu'une énergie de réaction chimique, quelle qu'elle soit, peut se décomposer en trois éléments :
- une énergie de répulsion entre les noyaux des différents atomes, tous chargés positivement ;
- une énergie, répulsive également, d'interaction entre les électrons, tous chargés négativement ;
- une énergie de liaison entre électrons qui équivaut à la moyenne de l'énergie nécessaire à arracher un électron d'un atome.

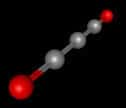
Des chimistes américains proposent de décomposer l’énergie de réaction (E) en trois termes : l’énergie moyenne de liaison (n̅χ), la répulsion noyau-noyau (VNN) et les interactions électrons-électrons (ω). © Rahm and Hoffmann, 2015 American Chemical Society
L'électronégativité mesurée par l'expérience
L'un des plus grands défis de la chimie computationnelle est de parvenir à quantifier les interactions électrons-électrons. Traditionnellement, les informations concernant ces interactions sont données par les théories de la mécanique quantique. Grâce aux travaux des chercheurs de l'université de Cornell, il devient aujourd'hui possible d'aborder cet aspect de la chimie quantique différemment et d'estimer, avec toutes les approximations inhérentes, les interactions électrons-électrons à partir de données expérimentales.
Les chimistes américains proposent également de considérer le troisième terme - l'énergie de liaison - comme découlant de l'un des concepts fondamentaux de la chimie : l'électronégativité. Selon la première définition donnée de ce terme en 1932, l'électronégativité correspond à la capacité d'un atome à attirer des électrons à lui. Elle est à la base de formation des liaisons chimiquesliaisons chimiques. Une autre proposition, faite en 1989 et très proche de celle-ci, définit l'électronégativité comme l'énergie de liaison moyenne des électrons de valenceélectrons de valence. L'avantage de cette dernière définition, c'est qu'elle permet de la mesurer par l'expérience. C'est ce que Martin Rahm et Roald Hoffmann ont fait, et ce en prenant en considération l'ensemble des électrons des atomes et pas seulement ceux de valence.
Classer les réactions chimiques selon les échanges d'énergie
Être capable de mesurer expérimentalement l'énergie de liaison moyenne entre les électrons ainsi que les énergies de répulsions, entre les noyaux d'une part et les électrons d'autre part, ouvre des perspectives complètement nouvelles. Plus important encore, il devient possible de déterminer, par l'expérience, quel est le pourcentage de chacune des composantes dans l'énergie de réaction totale. Cette information devrait permettre de classer les réactions chimiques, et même les transformations physiquesphysiques, en huit grandes catégories selon qu'elles consomment ou qu'elles libèrent de l'énergie et selon qu'elles sont encouragées ou non par les interactions noyau-noyau et électrons-électrons ou par l'énergie de liaison. De quoi obtenir des informations précieuses quant à la nature des liaisons chimiques mises en jeu.
Les chercheurs ont ainsi d'ores et déjà pu montrer que dans quatre des huit catégories de réactions, des informations concernant l'énergie de liaison sont suffisantes à savoir si la réaction va se poursuivre ou non. En d'autres mots, les chercheurs pourront désormais savoir à l'avance s'ils peuvent ou non se fier au concept d'électronégativité pour prédire les échanges d'énergie au cours d'une réaction.
La prochaine étape consistera en l'étude détaillée de la nature des liaisons chimiques dans des molécules diatomiques comme le diazote (N2) ou le monoxyde de carbonemonoxyde de carbone (CO). Puis les chimistes travailleront sur des réactions plus complexes. De quoi tester les limites de cette approche totalement nouvelle. Si les prédictions des chercheurs de l'université de Cornell se vérifiaient, cela pourrait révolutionner notre façon de comprendre les propriétés de la matièrematière.