Le rôle des facteurs génétiquesgénétiques dans l'étiologie de la maladie d'Alzheimermaladie d'Alzheimer est fondamental, mais seul un nombre restreint de familles à travers le monde présentent une transmission autosomiqueautosomique dominante de la maladie.

Que deviennent nos souvenirs ? © Gabriele Rohde - Fotolia
Par Armand Savioz, Geneviève Leuba, Philippe Vallet et Claude Walzer
Trois gènesgènes sont impliqués, codant soit pour le précurseur du peptide Aß (bêta-amyloïdebêta-amyloïde), soit pour les présénilines 1 et 2. Par ailleurs, l'allèleallèle E4 de l'apolipoprotéine constitue un facteur de risque pour la maladie. D'autres allèles et des mutations sur d'autres gènes ont été proposés comme candidats, mais leur implication dans la maladie d’Alzheimer nécessite plus ample corroboration.
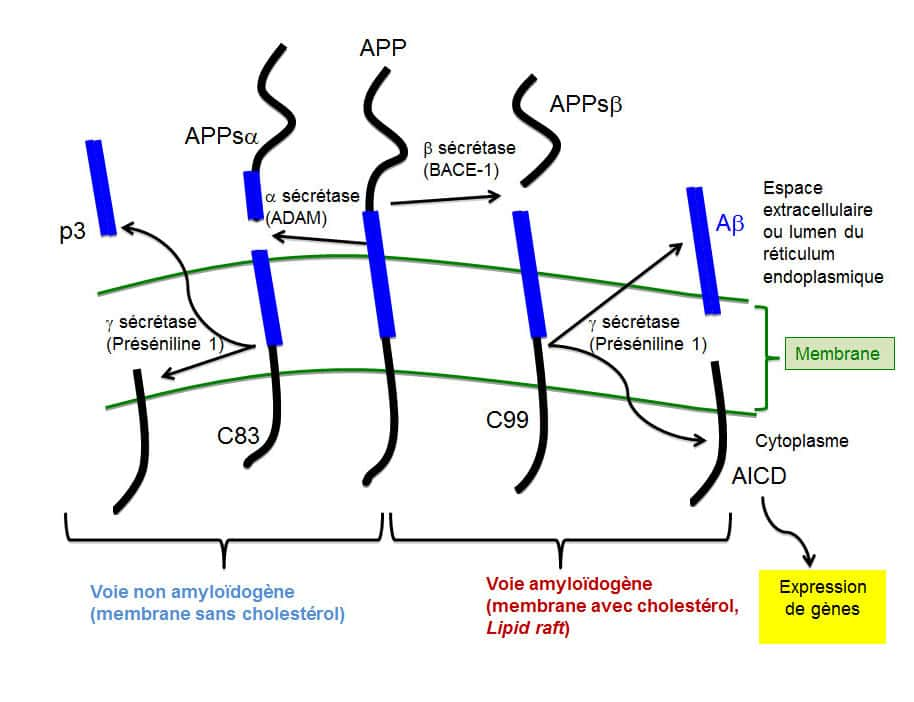
Les gènes du précurseur du peptide Aß (APP) ou des présénilines (PS1 et PS2) mutent et favorisent la production du peptide Aβ (voie amyloïdogène). © DR
Selon l'hypothèse de la cascade amyloïde, les mutations sur les gènes du précurseur du peptide Aß (APP) ou des présénilines (PS1 et PS2) vont faciliter la coupure du précurseur et ainsi favoriser la production du peptide Aβ (voie amyloïdogène). En effet la préséniline 1 est une protéaseprotéase, appellée gamma-sécrétase. La génération du peptide Aβ nécessite l'action d'une autre protéase la bêta-sécrétase. Les peptidespeptides peuvent ensuite oligomériser, polymériser puis donner des dépôts extracellulaires qui constituent les plaques séniles.
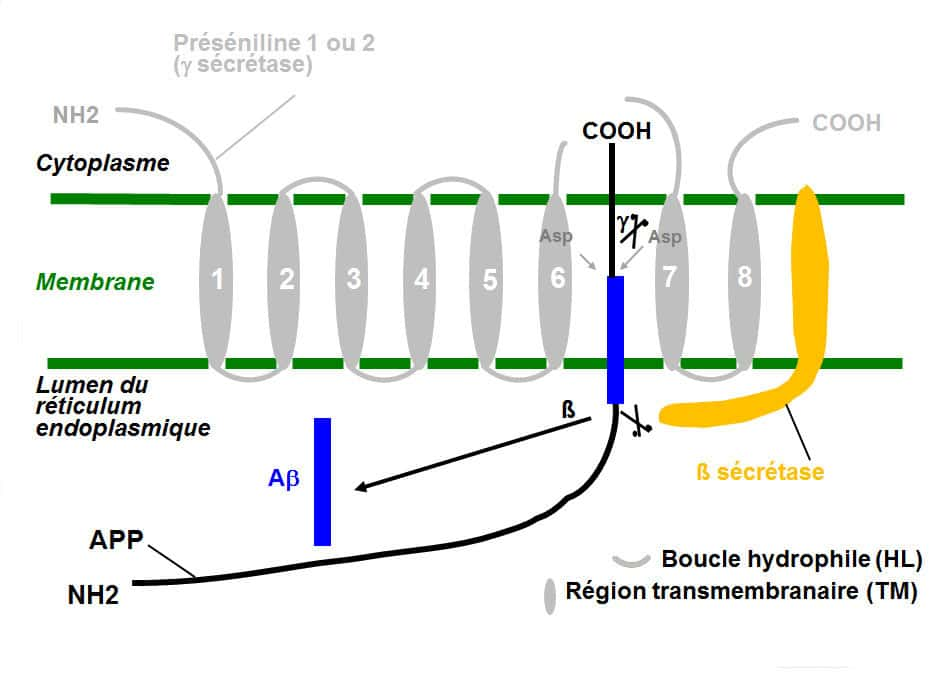
L’apolipoprotéine E permet de réparer les membranes cellulaires, et d’éliminer le peptide Aβ. © DR
L'apolipoprotéine E serait utile non seulement à réparer les membranes cellulairesmembranes cellulaires, mais aussi à éliminer le peptide Aβ. Elle jouerait un rôle neuroprotecteur. Toutefois chez les personnes portant un variant génétique de cette protéineprotéine, l'allèle E4 (dont la protéine ApoE4 diffère uniquement par deux acides aminésacides aminés de l'ApoE3), l'élimination du peptide Aß se ferait moins efficacement, d'où un renforcement de la cascade amyloïde et un risque pathologiquepathologique plus élevé.
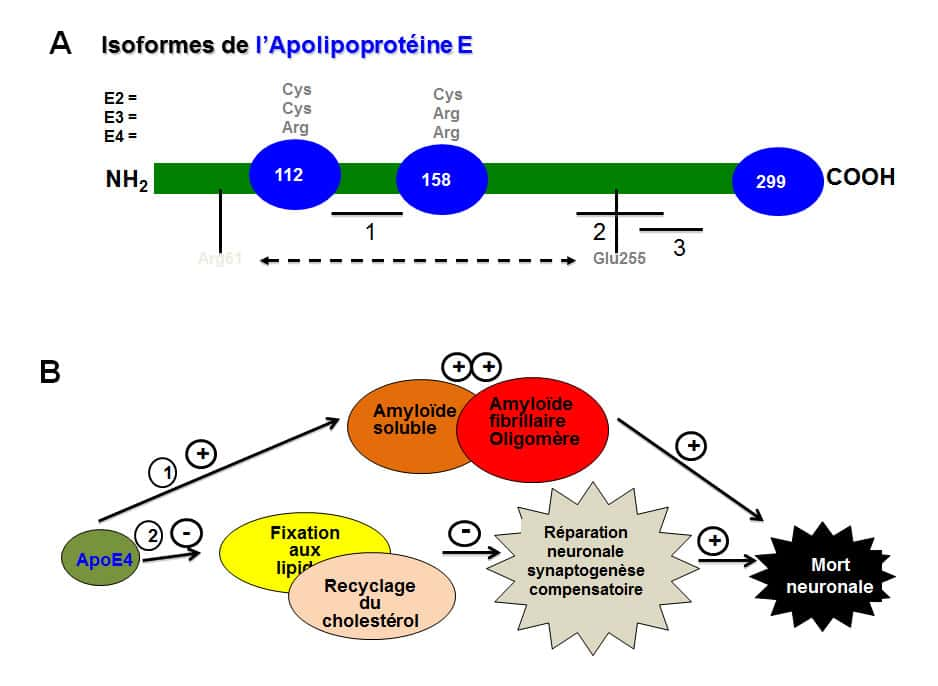
L’allèle E4 de l'apolipoprotéine (ApoE4) est un facteur de risque pour la maladie d’Alzheimer. © DR
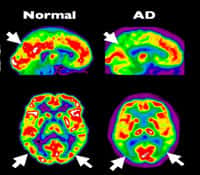
Les principales hypothèses étiopathologiques pour la maladie d'Alzheimer sont formulées autour de la cascade amyloïde et de la dégénérescence du cytosquelettecytosquelette neuronal.
L'oligomérisation du peptide Aß serait l'élément clé à l'origine de la pathologiepathologie (agissant notamment sur les synapsessynapses et les mitochondriesmitochondries) alors que la protéine Tau serait un élément nécessaire mais non suffisant.
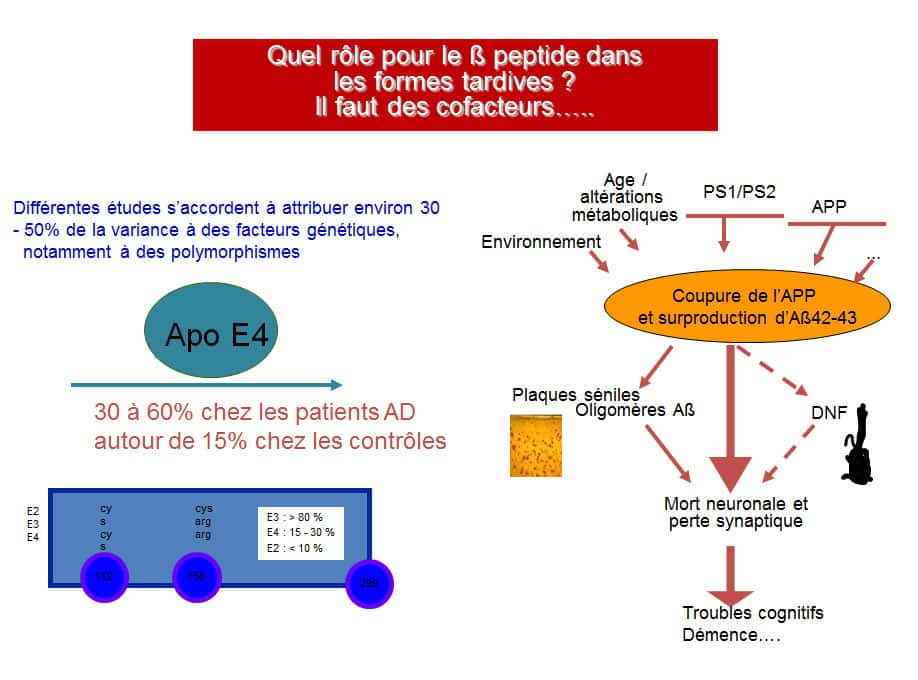
Une série de facteurs combinés (âge, altérations métaboliques, mutations sur certains gènes…) influent sur le risque de développement de la maladie d’Alzheimer. © DR
Cependant une conception synapto-connexionniste, tenant compte du fonctionnement des réseaux, est nécessaire pour comprendre la progression de cette pathologie. Des facteurs neuroprotecteurs pourraient, via leur action sur les réseaux de neuronesneurones, contribuer déjà avant l'âge adulte à la formation de réserves différant la survenue de la pathologie.
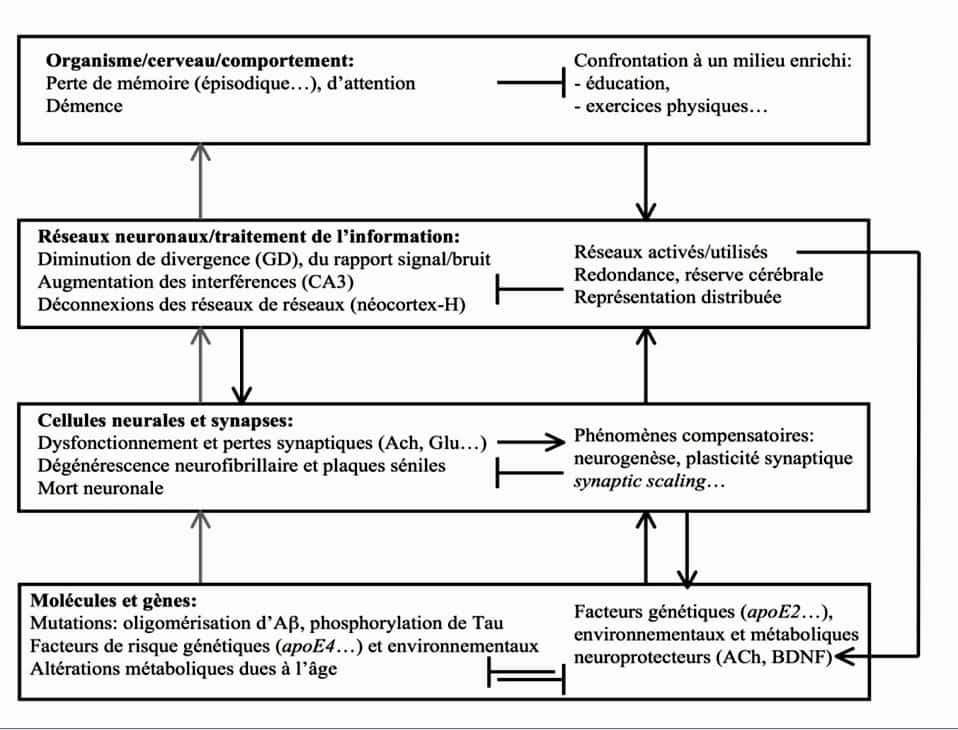
Même avant l’âge adulte, l’interaction de facteurs neuroprotecteurs variés pourrait favoriser l'apparition plus tardive de la maladie. © DR