au sommaire
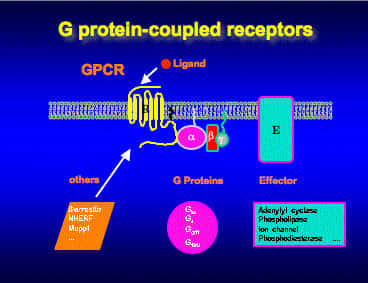
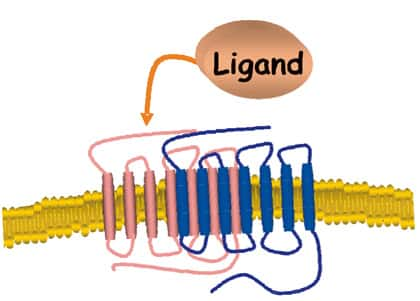
Les récepteurs couplés aux protéines G
Les récentes données du séquençageséquençage du génomegénome humain ont révélé l'existence d'environ 750 gènesgènes codant pour des RCPG à 7 domaines transmembranaires. Ces récepteurs sont impliqués dans la plupart des processus physiologiques et leur dysfonctionnement ou leur absence est à l'origine de nombreuses maladies.
Typiquement, ces récepteurs transmettent les signaux de l'environnement extérieur à l'intérieur de la cellule en activant des protéines Gprotéines G hétérotrimériques. Celles-ci une fois activées transmettent leur signal à des effecteurs (enzymes, canaux ioniquescanaux ioniques).

Notre modèle d'étude, les récepteurs de la mélatoninemélatonine (MTR), font partie de la super famille des RCPG. Chez l'homme, trois récepteurs appartenant à la sous-famille des MTR, appelés MT1, MT2 et GPR50, ont été clonés. Leur ligand, la mélatonine, est impliquée dans toute une série de processus physiologiques comme le rythme circadienrythme circadien, le cycle de reproduction saisonnier, le sommeilsommeil, mais très probablement aussi dans le cancercancer, des désordres mentaux et les maladies neuro-dégénératives. Cette hormonehormone, sécrétée par la glande pinéaleglande pinéale de façon circadienne, avec un pic de concentration pendant la nuit, cible les récepteurs MT1 et MT2. En revanche, GPR50 est insensible à la mélatonine et fait partie des RCPG orphelins (sans ligand connu).
1- L’oligomérisation des MTR
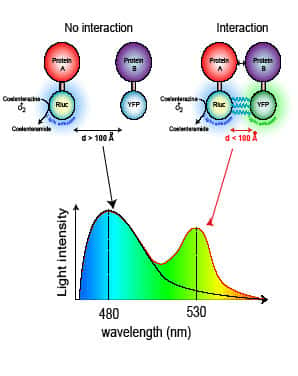
La plupart des membres de la famille des RCPG peuvent former des homohomo- et des hétérodimères avec des conséquences fonctionnelles importantes pour leur pharmacologie, leur signalisation et leur régulation. Les MTR n'y font pas exception ! L'équipe utilise la technique de BRET (BioluminescenceBioluminescence Resonance Energy Transfert) et des méthodes biochimiques pour étudier l'oligomérisation et sa relation avec l'état d'activation des récepteurs.
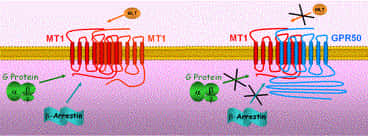
A) L’hétérodimérisation du récepteur MT1 et de GPR50
Malgré les efforts intenses de la recherche industrielle et académique pour trouver un ligand pour chacun des 380 RCPGs non-olphactifs, plus de 140 récepteurs restent encore orphelins sans ligand). La compréhension de la fonction de ces récepteurs orphelins reste un défi majeur puisque ces récepteurs sont la cible privilégiée de nombreuses droguesdrogues.
Nous avons montré que le récepteur orphelin GPR50 hétérodimérise constitutivement avec le récepteur MT1. De façon intéressante, l'engagement du récepteur orphelin GPR50 au sein de l'hétérodimère avec MT1 liantliant la mélatonine, a de profondes conséquences sur la fonction de MT1, à savoir l'inhibitioninhibition des sites de liaison de haute affinité pour l'agonisteagoniste, le couplage des protéines G hétérotrimériques et la fixation des β-arrestines. Une analyse plus détaillée a montré que la longue extrémité C-terminale de GPR50 prévient le recrutement de partenaires d'interaction intracellulaires au sein de l'hétérodimère.
La pertinence de l'effet inhibiteur de GPR50 sur la fonction de MT1 a été confirmée par les résultats obtenus dans les cellules endothéliales cérébrales humaines hCMEC/D3 récemment immortalisées. L'extinction par siRNA du messager codant pour GPR50 a révélé que les niveaux d'expression endogènesendogènes de GPR50 étaient suffisants pour abolir toute activité du récepteur MT1.
2 - Les partenaires d’interaction des MTR
Afin de mieux comprendre la régulation et les voies de signalisation liées aux récepteurs MT1 et MT2 (MTR) et d'identifier d'éventuelles cibles pharmacologiques, trois approches ont été développées dans l'équipe pour l'identification et la caractérisation des partenaires protéiques interagissant avec ces récepteurs. A une approche initiale de criblage par double hybridehybride dans la levurelevure en collaboration avec la société Hybrigenics (Paris) sont venues s'ajouter deux approches protéomiques complémentaires : la purification des complexes protéiques associés aux MTR exprimés en lignée cellulaire par Tandem Affinity Purification (TAP) et la purification de protéines de lysats de cerveaux de souris interagissant avec la queue C-terminale des MTR par chromatographie d'affinité. Pour ces deux dernières techniques, les protéines éluées de la matrice d'affinité sont séparées par électrophorèse mono- ou bi-dimensionnelle et analysées par spectrométrie de massespectrométrie de masse.
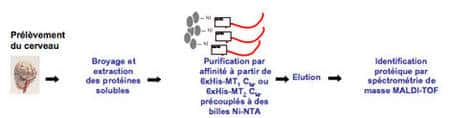
Approche à partir de la queue cytoplasmique du récepteur : Cette approche est basée sur l'interaction de protéines issues de lysats de cerveaux de souris avec la queue cytoplasmique des MTR immobilisée sur une matrice. Une étiquette poly-histidinehistidine placée à l'extrémité N-terminale du peptide permet son immobilisation sur des billes recouvertes de nickelnickel.
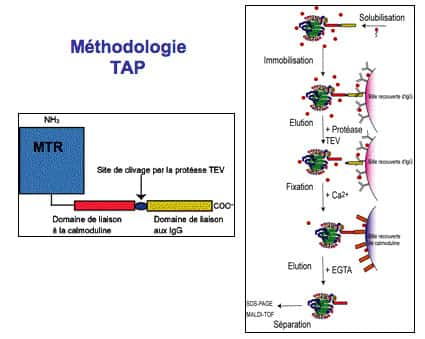
Approche à partir du récepteur entier (TAP) : La technique de purification par TAP repose sur la fusionfusion du récepteur "entier" avec une étiquette portant deux modules d'affinité séparés par un site de clivageclivage par une protéaseprotéase spécifique. Cette méthode permet d'effectuer une purification de complexes protéiques en condition native. Les modules choisis sont un couple de domaines de liaison aux IgG et un domaine de liaison à la calmoduline.
3 - La famille des MTR et les désordres mentaux
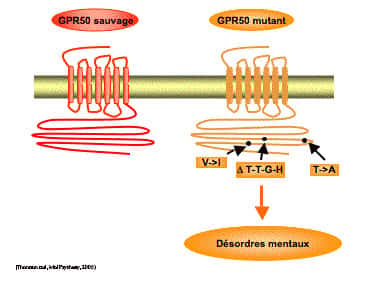
Bien que des avancées importantes aient été enregistrées dans le domaine de la dépression, les bases moléculaires de celle-ci restent largement incomprises. Il est urgent de trouver des antidépresseursantidépresseurs plus efficaces et mieux tolérés pour ces maladies qui touchent 20 à 30% des individus au cours de leur vie, et dont l'incidenceincidence croît avec l'âge. De récentes découvertes montrent que les personnes présentant des mutations particulières du gène codant pour GPR50 ont une prédispositionprédisposition aux dépressions majeures. Les fonctions de GPR50, qui restent à déterminer, pourraient donc expliquer le lien observé entre excès de mélatonine et épisodes dépressifs. De plus, des évidences pharmacologiques suggèrent un rôle clé des récepteurs MT1 et MT2 dans certaines formes de dépression chez l'homme. D'ailleurs, une nouvelle génération d'antidépresseurs ciblant ces récepteurs doit être bientôt mise sur le marché. Pour ouvrir de nouvelles perspectives dans ce domaine, nous sommes en train de caractériser ces récepteurs et leurs gènes en collaboration avec l'équipe du Prof MO Krebs à l'Hôpital St. Anne.
4 - Les MTR dans les maladies neuro-dégénératives
Les troubles du sommeiltroubles du sommeil, les insomniesinsomnies ainsi que d'autres perturbations du rythme circadien sont fréquemment retrouvés chez les patients âgés et d'autant plus chez ceux sévèrement atteints de la maladie d'Alzheimermaladie d'Alzheimer. Ces troubles sont les principales raisons pour lesquelles ces patients atteints d'Alzheimer sont hospitalisés. Les taux de mélatonine diminuant au cours du vieillissement, en particulier dans les cas d'Alzheimer, l'administration de mélatonine est envisagée comme un traitement potentiel des troubles circadiens liés à cette pathologiepathologie. Nous nous intéressons plus particulièrement à la détection d'altérations potentielles des MTR chez les patients atteints de cette maladie. Grâce à l'utilisation d'anticorpsanticorps développés par notre équipe et par l'équipe des Drs. F. Fraschini et D. Angeloni, nous avons caractérisé l'expression des MTR par immunohistochimie dans la rétinerétine et diverses structures du cerveaucerveau.
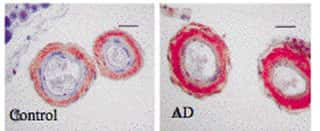
Marquage vasculaire de MT1 (coloration rouge) dans l'hippocampehippocampe : Augmentation de l'immunoréactivité des récepteurs MT1 chez les patients atteints d'Alzheimer (AD) (Savaskan et al. Neuroscience Letters, 2001).