au sommaire
- À lire aussi
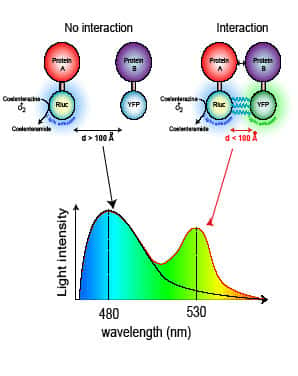
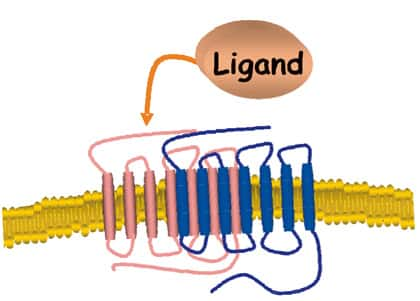
La méthodologie BRET
Au cours de l'année 1999, une nouvelle technique, représentant une avancée considérable pour l'étude des interactions protéineprotéine-protéine, a été mise au point : la technique de BRET (BioluminescenceBioluminescence Resonance Energy Transfer).

Cette technique est dérivée d'un processus biologique naturel, existant dans un organisme marin, chez lequel l'énergie émise par une luciférase excitée est transmise à une GFPGFP (Green Fluorescence Protein) qui émet alors de la lumière à une autre longueur d'onde. Dans la technique de BRET, la luciférase de Renilla est fusionnée à une protéine d'intérêt (protéine A).
La GFP est fusionnée à l'autre protéine d'intérêt (protéine B), susceptible d'interagir avec la protéine B. La luciférase est excitée à l'aide d'un substratsubstrat qui pénètre dans la cellule (cœlenterazine). Si les deux protéines n'interagissent pas, on ne détecte que le signal émis par la luciférase à 480 nm.
Si les deux protéines interagissent, il y a transfert d'énergie entre la luciférase et la GFP et l'on peut mesurer un signal supplémentaire émis par la GFP à 530 nm. Le transfert d'énergie reflète une interaction physique étroite : pour qu'il y ait transfert d'énergie, la distance entre la luciférase et la GFP doit être inférieure à 100 Å.