au sommaire
- 2.6.1. DETERMINATIONS DES CONDITIONS OPTIMALES DE STIMULATIONS
- 2.6.1.1. Lymphocytes et monocytes
- 2.6.1.1.1. Action du LPS
- 2.6.1.1.2. Action du calcium ionophore
- 2.6.1.1.3. Action du PMA
- 2.6.1.2. Les granulocytes neutrophiles
- 2.6.1.2.1. Action du LPS
- 2.6.1.2.2. Action du calcium ionophore
- 2.6.1.2.3. Action du PMA
- 2.6.1.3. Sang total
- 2.6.1.3.1. Action du LPS
- 2.6.1.3.2. Action du calcium ionophore
- 2.6.1.3.3. Action du PMA
- 2.6.1.4. Inhibition de la synthèse de COX-2
- 2.6.1.4.1. La dexaméthasone
- 2.6.1.4.2. Le chlorure de chélérythrine
- 2.6.1.5. Conclusion sur les conditions de stimulation des cellules
- 2.6.2. INFLUENCE DE L'ACIDE ARACHIDONIQUE
- 2.6.2.1. Ajout de l'acide arachidonique au milieu
- 2.6.2.2. Blocage sélectif de COX-1
- 2.6.3. CINETIQUE DE PRODUCTION DU THROMBOXANE B2
- 2.6.4. VALIDATION DU MODELE
- 2.6.5. TEST DE MOLECULES ORIGINALES
- À lire aussi
Résultats
2.6.1. DETERMINATIONS DES CONDITIONS OPTIMALES DE STIMULATIONS
Afin de définir les conditions optimales pour avoir une quantité maximale de chacune des isoenzymes, nous avons fait varier les conditions de stimulation d'une suspension composée de lymphocyteslymphocytes et de monocytesmonocytes. Nous avons choisi ces cellules car nous avons précisé dans la partie introductive que ce sont ces cellules qui sont à priori les plus favorables à notre modèle. Ensuite nous avons renouvelé nos expérimentations en prenant comme matériel cellulaire les granulocytesgranulocytes neutrophilesneutrophiles puis nous avons travaillé sur sang total.
Les activateurs employés sont le LPSLPS, le calcium ionophore et le PMAPMA, à différentes concentrations et avec différents temps d'incubation.
2.6.1.1. Lymphocytes et monocytes
2.6.1.1.1. Action du LPS

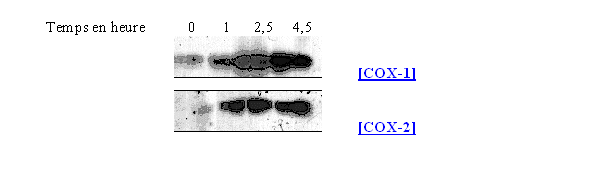
fig. 62 : Action sur la synthèse de COX-1 et COX-2 du LPS 10 µg/ml à différents temps sur les lymphocytes et les monocytes
L'incubation des cellules avec le LPS s'est faite avec le LPS à différents temps : 1 / 2,5 et 4,5 heures avec une concentration de 10 µg/ml (fig. 62).
Ce premier résultat permet de confirmer que la COX-1 est constitutive puisqu'elle est présente dès le temps 0, puis sa quantité semble augmenter pour un temps de 4,5 heures. La COX-2 est quant à elle inductible car au temps 0 elle est totalement absente du milieu et sa quantité maximale est obtenue pour une incubation de 2,5 heures et reste stable par la suite.
Pour déterminer les concentrations optimales en LPS nous avons recommencé l'étude en prenant comme temps de stimulation 4,5 heures (fig. 63).
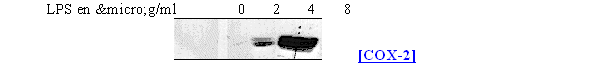
fig. 63 : Influence de la concentration en LPS sur la synthèse de COX-2 chez les lymphocytes et monocytes
La synthèse de COX-2 est absente pour une concentration en LPS de 2µg/ml et elle commence à être visible pour une concentration de 4µg/ml, dans ce cas il est même possible de distinguer le doublet caractéristique, dû aux glycosilation, représentant l'enzyme. La maximum de protéineprotéine est obtenu avec une concentration de 8µg/ml. Comme la COX-1 est constitutive, elle a été détectée dans les mêmes proportions dans les 4 cas de figure.
2.6.1.1.2. Action du calcium ionophore
Comme dans le cas du LPS, cette expérimentation s'effectue en deux temps : une variation de la durée de stimulation puis une variation de la concentration en activateur.
Nous avons surtout cherché à voir l'influence que pouvait avoir le calcium ionophore sur la synthèse de la COX-2, pour cela les cellules ont été incubées avec l'activateur à 100µM pendant différents temps (fig. 64).
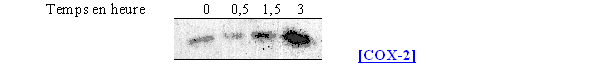
fig. 64 : Action du calcium ionophore sur la synthèse de COX-2.
Le calcium ionophore n'a qu'une faible influence sur la quantité de COX-1 du fait du caractère constitutif de cette enzyme. Par contre, avec une durée de stimulation de 3 heures, nous avons une production de la COX-2 significative alors que pour les temps inférieurs, sa présence est peu importante.
Nous avons ensuite renouvelé l'étude en faisant varier les concentrations en calcium ionophore et en fixant le temps de stimulation à 3 heures (fig. 65).

fig. 65 : Influence de la concentration en calcium ionophore sur la synthèse de COX-2.
Pour des concentrations inférieures à 20µM, la COX-2 n'est pas produite. A partir de 50µM, l'enzyme est à peine détectable puis à 75µM sa synthèse se fait dans des proportions normales.
Ceci montre que pour des concentrations élevées et des temps de stimulation importants, il est possible d'induire la transcriptiontranscription et la traduction de la COX-2. Il sera donc nécessaire par la suite de limiter ces facteurs de façon à ce qu'ils n'influent pas sur les résultats concernant la COX-1.
2.6.1.1.3. Action du PMA
Nous avons choisi de tester ce stimulant car nous avons remarqué dans nos premiers travaux qu'il est capable d'activer la PKC. Or cette enzyme intervient dans les voies de transductiontransduction qui permettent la synthèse de la COX-2. La concentration optimale, 160 nM, ayant été définie dans le modèle concernant la PKC, nous n'avons regardé que l'influence du temps de stimulation (fig. 66).

fig. 66 : Influence du PMA sur la synthèse de COX-2.
La COX-2 est nettement détectable au bout de 1,5 heure de stimulation par le PMA 160nM, mais il est à noter que la quantité produite est inférieure par rapport à celle obtenue par une activation par le LPS 8µg/ml pendant des délais d'activation similaires. La COX-1 est présente dans les même proportions dans tous les cas.
2.6.1.2. Les granulocytes neutrophiles
Dans le but de vérifier qu'un milieu composé de lymphocytes et de monocytes est le meilleur choix de cellules envisageables, nous avons testé les granulocytes neutrophiles humains afin de pouvoir comparer les quantités de protéine produite.
2.6.1.2.1. Action du LPS
Nous avons incubé les granulocytes neutrophiles avec le LPS à 10µg/ml pendant différents temps (fig. 67).

fig. 67 : Influence du LPS sur la synthèse de COX-1 et COX-2 chez les polymorphonucléaires neutrophiles.
Les quantités de protéine correspondant à COX-1 sont inférieures à celles obtenues avec les lymphocytes et les monocytes ; nous pouvons constater de plus que la COX-1 est constitutive mais que par rapport à la référence, elle ne semble pas augmenter de façon significative.
La COX-2 est quant à elle induite, à partir d'une heure de stimulation et avec un maximum à 4,5 heures, dans les mêmes proportions que celles relevées lors de l'activation par les lymphocytes et les monocytes ; mais il semblerait que son niveau de base soit plus élevé que dans le premier cas étudié.
Nous avons ensuite cherché à voir si la concentration en LPS avait la même influence sur la synthèse de COX-2 que dans le cas des monocytes et des lymphocytes. L'activation se fait en 3 heures (fig. 68).
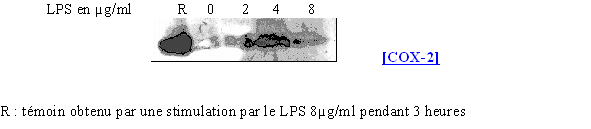
fig. 68 : Influence du LPS sur la synthèse de COX-2.
Avec une durée de stimulation identique entre les lymphocytes et les granulocytes neutrophiles, la quantité de protéine détectée est beaucoup plus faible dans le cas des polymorphonucléaires neutrophiles. Toutefois, nous sommes capables de retrouver le caractère inductible de la COX-2 à partir d'une concentration de 4µg/ml de LPS.
2.6.1.2.2. Action du calcium ionophore
Comme cela a été réalisé avec les lymphocytes et les monocytes, nous avons incubé les granulocytes neutrophiles avec le calcium ionophore à différents temps avec une concentration de 100µM (fig. 69) puis à différentes concentrations avec une stimulation de 3 heures (fig. 70) pour visualiser son action sur les cyclooxygénases dans ce type de cellules.
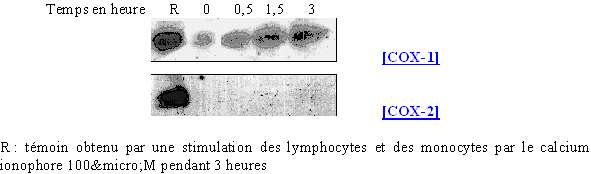
fig. 69 : Action du calcium ionophore sur la synthèse de COX-2 et COX-1.
Dans ce premier cas de figure, nous obtenons pour COX-1, une quantité de protéines bien plus faible pour une stimulation des granulocytes neutrophiles ; nous pouvons observer une légère augmentation de cette quantité au cours du temps. Pour COX-2, le calcium ionophore n'induit pas la transcription et la traduction de cette isoforme quelle que soit la durée d'activation.
En mettant une concentration fixe de calcium ionophore et en faisant varier le temps, nous avons toujours la même proportion de COX-1. Comme dans le cas précédent, la transcription et la traduction de la COX-2 n'a pas été induite par cet activateur, quelle que soit la concentration employée.
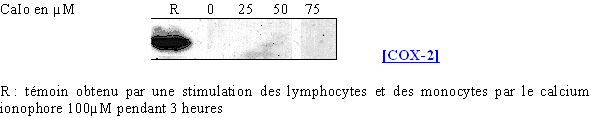
fig. 70 : Influence de la concentration en calcium ionophore sur la synthèse de COX-2.
2.6.1.2.3. Action du PMA
Pour visualiser l'action d'un activateur de la PKC sur la synthèse de la COX-2 chez le granulocyte neutrophile, ces cellules ont été incubées à divers temps avec le PMA à la concentration de 160 nM (fig. 71).

fig. 71 : Influence du PMA sur la synthèse de COX-2 chez le granulocyte neutrophile.
Pour le temps 0, l'enzyme est absente. Sa synthèse commence à partir de 30 minutes de stimulation par le PMA 160nM, le maximum est obtenu après 1,5 heure et la quantité présente est comparable avec celle que nous avions obtenue dans le cas des lymphocytes.
2.6.1.3. Sang total
Cette étape a pour but de vérifier qu'aucun autre constituant sanguin n'est susceptible d'interférer sur l'activation de la COX-2 (plaquettesplaquettes, protéines plasmatiques ...). Comme nous avons fait varier les conditions de concentrations et de temps pour divers stimulants pour les cellules étudiées précédemment, nous avons procédé de même pour cette étape.
D'un point de vue pratique, la méthode est la suivante : dans 1 ml de sang est ajouté si nécessaire, le stimulant et le tout est mis à incuber pour une durée définie. Ensuite, les suspensions sont hémolysées par ajout de 5,6ml de NH4Cl, puis les milieux sont centrifugés à 400g pendant 10 minutes, les culots sont repris par 500 µl de tampon de lyse, la suite du protocoleprotocole est identique à celui utilisé dans le cas des cellules précédentes.
2.6.1.3.1. Action du LPS
Comme lors des essais précédents, nous avons fait varier le temps d'incubation avec une concentration fixée en LPS de 10µg/ml (fig. 72), puis le temps est constant à 3 heures avec une concentration variable en LPS (fig. 73).
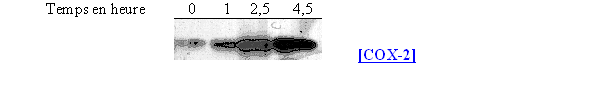
fig. 72 : Influence du LPS sur la synthèse de COX-2 sur le sang total.
La COX-1 n'est pas affectée par l'activation et conserve son caractère constitutif. En ce qui concerne la COX-2, son niveau basalbasal est faible comme nous l'avions déjà constaté dans les cas précédents, par contre son niveau maximum d'induction est obtenu pour une stimulation de 4,5 heures.
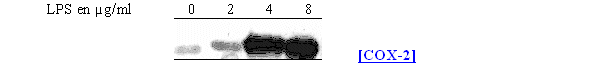
fig. 73 : Influence de la concentration en LPS sur la synthèse de COX-2 dans le sang total.
Pour un milieu de référence ne contenant pas de LPS, la COX-2 est à peine détectable, elle commence à apparaître pour une concentration de 2µg/ml, son niveau maximum est obtenu à partir d'une concentration de 4µg/ml. En ce qui concerne la COX-1, son niveau d'expression n'est que très peu affecté par la présence du LPS.
2.6.1.3.2. Action du calcium ionophore
De même que précédemment, les milieux sont tout d'abord incubés avec une concentration constante en calcium ionophore, 100µM, et avec des temps variables (fig. 74) ; puis ce sont les temps qui sont constants à 3 heures avec différentes concentrations en activateur (fig. 75).

fig. 74 : Action du calcium ionophore sur la synthèse de COX-1 et COX-2.
Pour les différents temps employés, la quantité de COX-1 est stable, par contre, la COX-2 n'a pu être mise en évidence pour une durée de stimulation inférieure à 30 minutes, elle commence à être visible à partir de 1,5 heure et son maximum est à 3 heures d'activation par le calcium ionophore 100 µM.

fig. 75 : Influence de la concentration en calcium ionophore sur la synthèse de COX-2 dans le sang total.
Le niveau d'expression de la COX-1, comme pour tous les résultats observés en sang total, n'est pas changé par une stimulation par le calcium ionophore. La COX-2 est très faiblement exprimée, en effet elle commence à être détectée à partir d'une concentration en calcium ionophore de 50 µM et sa quantité maximale est nettement inférieure à celle que nous avons déjà eue l'occasion de rencontrer dans ces différents cas de stimulation.
2.6.1.3.3. Action du PMA
Comme pour les autres types cellulaires, nous allons voir l'influence que peut avoir un ester de phorbol sur l'expression de la COX-2 dans le sang total (fig. 76).
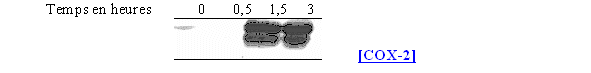
fig. 76 : Action du PMA sur la synthèse de COX-2 dans le sang total.
Les milieux ont été incubés avec le PMA à la concentration de 160 nM pour différents temps. Pour une stimulation inférieure à 30 minutes, il n'est pas possible de détecter cette enzyme, par contre à partir de 1,5 heure elle facilement visualisable.
2.6.1.4. Inhibition de la synthèse de COX-2
Afin de vérifier la capacité de notre modèle à rendre compte d'une présence ou non de la COX-2, nous avons essayé d'inhiber sa synthèse. Nous avons testé un corticoïdecorticoïde, la dexaméthasone, qui est connu pour bloquer la transcription de cette enzyme, ensuite nous avons utilisé le chlorure de chélérythrine afin de voir s'il pouvait influer sur cette transcription, et ainsi vérifier la fiabilité de la voie de transduction utilisant la PKC.
2.6.1.4.1. La dexaméthasone
Nous avons incubé les lymphocytes et les monocytes avec le LPS 8µg/ml pendant 3 heures en présence de deux concentrations en corticoïde : une faible de 50nM et une forte de 8µM (fig. 77).
Les résultats que nous obtenons sont conformes à ceux attendus, c'est à dire que la COX-1 est présente avec la même quantité de protéines quel que soit le milieu, tandis que la COX-2 est présente au niveau du milieu servant de référence activée et absente pour les deux concentrations en dexaméthasone. Ceci permet de montrer que notre modèle respecte les voies normales de transcription et de traduction de la COX-2.
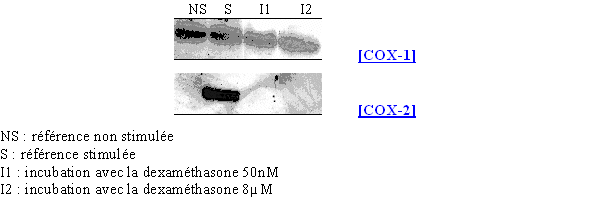
fig.77 : Action de la dexaméthasone sur la synthèse de COX-2.
2.6.1.4.2. Le chlorure de chélérythrine
Comme nous avons réussi à stimuler la synthèse de COX-2 par le PMA, nous avons voulu savoir si en inhibant la PKC, normalement activée par l'ester de phorbol, il était envisageable de bloquer la synthèse de COX-2. Pour cela, nous avons à nouveau incubé les lymphocytes et les monocytes avec deux concentrations en inhibiteur : une faible de 4µM et une forte de 40µM (fig. 78).

fig.78 : Action du chlorure de chélérythrine sur la synthèse de COX-2.
La COX-1 étant constitutive, ce composé n'a, logiquement, aucun effet sur la quantité d'enzyme présente dans les cellules. Ce qui est plus surprenant, c'est que le chlorure de chélérythrine que nous avons décrit comme inhibiteur de la PKC est incapable de bloquer la transcription et la traduction de COX-2. Il est possible d'expliquer ceci en se remémorant un schéma des voies de transduction conduisant à la synthèse de cette enzyme. En effet, dans le cas où la voie de la PKC serait coupée, la cellule a toujours la possibilité de faire intervenir d'autres enzymes afin de produire la cyclooxygénase dans de bonnes conditions.
2.6.1.5. Conclusion sur les conditions de stimulation des cellules
Cette première étape a consisté à définir le meilleur choix cellulaire ainsi que les conditions de stimulation les plus favorables à notre modèle. Les types cellulaires étudiés sont un mélange de lymphocytes et de monocytes, les granulocytes neutrophiles et le sang total. Nous avons clairement établi que l'emploi de polymorphonucléaires entraînait une quantité moindre de COX-2 produite, les proportions entre les lymphocytes et le sang total semblent être du même ordre de grandeurordre de grandeur, par contre le calcium ionophore paraît moins actif certainement à cause de liaisons avec les protéines plasmatiques. Notre choix s'est donc définitivement porté sur une suspension de lymphocytes et de monocytes humains.
En ce qui concerne les conditions de stimulation, le PMA est à écarter car les résultats que nous avons obtenus ne sont pas assez constants, ce qui risque d'entraîner une certaine variation au niveau des résultats futurs.
De plus, étant donné que la cellule est capable d'utiliser des voies parallèles pour induire la synthèse de COX-2, nous risquons de fausser nos résultats en employant ce composé. Le calcium ionophore a peu d'influence sur la COX-2 pour des temps d'activation inférieurs à 2 heures et avec des concentrations n'excédant pas les 50µM, la stimulation de COX-1 se fera donc, par la suite, avec le calcium ionophore 50µM avec un temps d'incubation de 1 heure.
Le LPS permet une transcription et une traduction de la COX-2 à partir de 2,5 heures de stimulation avec une concentration au moins égale à 8µg/ml. Pour être sûr de la bonne qualité de cette activation, la mesure de l'activité enzymatiqueenzymatique de la COX-2 se fera ultérieurement en pratiquant une incubation avec le LPS à la concentration de 8µg/ml pendant 3 heures.
2.6.2. INFLUENCE DE L'ACIDE ARACHIDONIQUE
Les conditions décrites précédemment sont valables pour une synthèse efficace et constante de COX-2 sans que celle-ci n'interfère avec l'activité de COX-1. Mais notre but étant de mesurer l'activité enzymatique de chaque isoenzyme, nous devons nous assurer que le substratsubstrat de la réaction enzymatique, l'acideacide arachidonique, ne soit pas en quantité limitante. Mais, il faut aussi vérifier que ce composé n'a pas d'influence sur les milieux cellulaires, notamment sur la synthèse de COX-2 et de COX-1. La concentration en acide arachidonique doit être comprise entre 10 et 100µM pour que le substrat ne soit pas en quantité limitante. Nous avons donc incubé les cellules avec des concentrations appartenant à cet ordre de grandeur.
2.6.2.1. Ajout de l'acide arachidonique au milieu
Nous avons incubé les cellules en présence de trois concentrations différentes : 5, 20 et 80µM en acide arachidonique sans activateur spécifique pendant 4 heures à 37°C. Les résultats obtenus ont été comparés avec des milieux de référence, à savoir une référence non activée, un milieu activé par le LPS et un autre stimulé par le calcium ionophore (fig. 79).
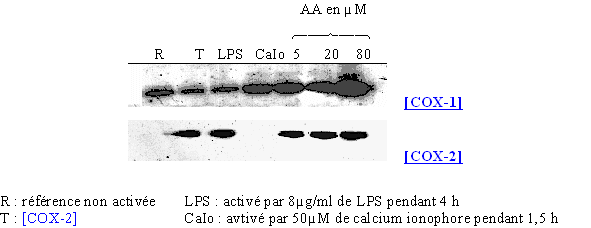
fig. 79 : Influence de l'acide arachidonique sur la synthèse de COX-1 et COX-2.
Nous avons pu vérifier sur le premier film que la COX-1 est présente dans toutes les conditions testées, confirmant son caractère constitutif. Il faut tout de même noter une légère augmentation de la quantité de protéines dans les cas où les lymphocytes et les monocytes sont incubés avec le calcium ionophore et l'acide arachidonique.
En ce qui concerne la COX-2, nous nous sommes assurés de la validité du blot en déposant un témoin COX-2. La protéine est normalement présente dans le cas d'une activation par le LPS dans les conditions définies auparavant et absente dans le cas d'une stimulation par le calcium ionophore. Pour les incubations avec l'acide arachidonique seul, nous pouvons noter que la COX-2 a été détectée dans des proportions similaires à celles obtenues par le LPS. Ceci montre que l'acide arachidonique est capable d'induire efficacement la transcription et la traduction de la COX-2.
A la vue de ces résultats, l'objectif est de trouver la concentration d'acide arachidonique à ajouter au milieu pour qu'il ne soit pas en concentration limitante, et pour qu'il n'active pas non plus la synthèse de COX-2 dans le cas où l'on étudierait l'activité de la COX-1.
Nous avons incubé les lymphocytes et les monocytes avec l'acide arachidonique à la concentration de 50µM avec et sans activateur spécifique pendant 1,5 heure à 37°C, avec le calcium ionophore et 4 heures à 37°C avec le LPS (fig. 80).

fig. 80 : Influence de l'acide arachidonique sur la synthèse de COX-2 en utilisant les conditions prédéfinies.
La COX-1 étant constitutive, elle est présente quelles que soient les conditions d'incubation pratiquées.
Dans les cas où les cellules sont incubées 4 heures avec soit l'acide arachidonique, soit le LPS, soit les deux en même temps, l'enzyme est présente dans les mêmes quantités, rendant possible une éventuelle mesure de l'activité enzymatique de cette protéine. Pour les incubations de 1,5 heure avec le calcium ionophore, l'acide arachidonique ou les deux composés ensemble, la COX-2 est indétectable, dans ce cas de figure c'est l'activité de la COX-1 qui peut être évaluée.
Les conditions d'incubation des lymphocytes et des monocytes retenues pour mesurer l'activité enzymatique de COX-1 sont 1 heure en présence d'acide arachidonique à 50µM et de calcium ionophore à 50µM, de cette façon la synthèse de COX-2 n'est pas induite. Pour cette dernière il se pose un autre problème, si les cellules sont incubées pendant 3 à 4 heures, la COX-1 est présente de façon active, ce qui interférerait avec une mesure de l'activité enzymatique de la COX-2. Il nous a donc fallu mettre en œuvre une stratégie afin de bloquer l'action de la COX-1.
2.6.2.2. Blocage sélectif de COX-1
Lorsque nous activons la COX-1, nous dosons le TxB2 produit uniquement par cette enzyme ; tandis que lorsque nous activons la COX-2 nous dosons à la fois le TxB2 produit par COX-1 et COX-2. L'objectif est de bloquer sélectivement et de façon irréversible le site actifsite actif de COX-1 avant d'activer COX-2 afin de mesurer le TxB2 produit exclusivement par COX-2 lors d'une activation par le LPS.
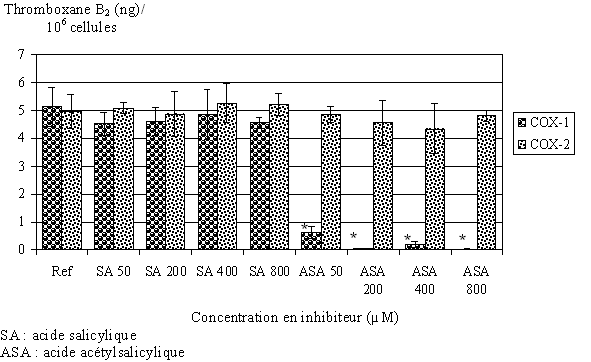
fig. 81 : Blocage de COX-1 et COX-2 en présence d'acide salicylique ou acétylsalicylique (n=3, * significativement différent de la référence pour p
Nous espérons pouvoir réaliser ce blocage par l'acide acétylsalicylique ou l'acide salicylique, métabolitemétabolite de l'aspirineaspirine dans l'organisme. Comme nous l'avons vu, l'acide acétylsalicylique a la possibilité de se fixer de façon covalente sur la sérinesérine 529 et sur l'argininearginine 120 située dans le site actif de l'enzyme.
Nous avons préincubé les lymphocytes et les monocytes avec différentes concentrations en acide acétylsalicylique ou acide salicylique pendant 30 minutes à 37°C. Puis, l'activation se fait par le calcium ionophore à 50µM pendant 1,5 heure pour COX-1, ou par le LPS à 8µg/ml pendant 4,5 heures à 37°C pour COX-2. Nous dosons ensuite le TxB2 produit dans chacun des cas (fig. 81).
En présence d'acide salicylique pour des concentrations comprises entre 50 et 800µM, la quantité de TxB2 produite par COX-1 n'est pas modifiée. Par contre, en présence d'acide acétylsalicylique la production de TxB2 est fortement diminuée pour une concentration de 50µM et inhibée à plus de 98% pour des concentrations plus élevées. Puisque les lavages interviennent avant la stimulation par le LPS, et que l'on mesure 5ng de TxB2 produits après l'activation par le LPS, il est possible d'en conclure que les lavages sont efficaces pour éliminer l'aspirine afin que celle-ci n'inhibe pas la COX-2.
Les lymphocytes et monocytes qui seront stimulés par le LPS seront donc préincubés par l'acide acétylsalicylique 500µM pendant 30 minutes à 37°C pour bloquer de façon irréversible la COX-1 puis les cellules seront lavées trois fois dans le but d'éliminer l'aspirine avant d'être incubées avec le LPS et l'acide arachidonique. De cette façon, nous ne mesurerons que le TxB2 produit par la COX-2 lors d'une activation par le LPS.
2.6.3. CINETIQUE DE PRODUCTION DU THROMBOXANE B2
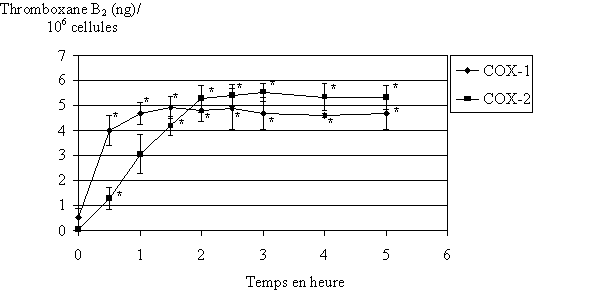
fig. 82 : Cinétique de production du TxB2 (n=3, * significativement différent de la référence pour p
Nous désirons déterminer la cinétique de production du TxB2 par les deux isoformes de cyclooxygénase. Les temps d'incubation des lymphocytes et des monocytes sont compris entre 0 et 5 heures. Ceci nous permettra de connaître avec certitude les quantités maximales de TxB2 que nous pouvons produire dans notre modèle (fig. 82).
Le maximum de production du TxB2 par COX-1 est atteint pour 1 heure d'incubation à 37°C. Celui de COX-2 est atteint pour 2,5 heures d'incubation à 37°C. Dans les deux cas, après avoir atteint son maximum, la quantité de TxB2 reste constante jusque 5 heures.
2.6.4. VALIDATION DU MODELE
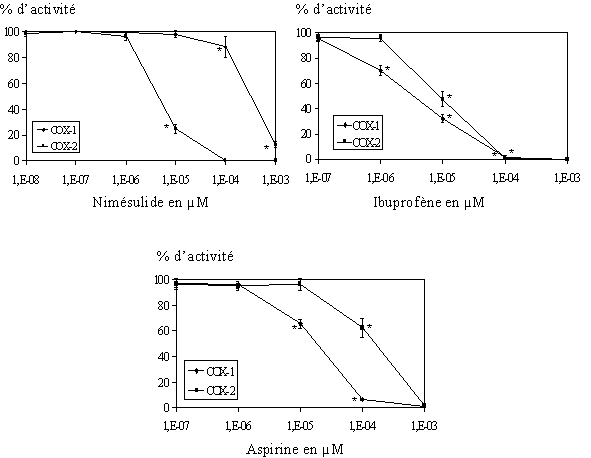
fig. 83 : Activité de COX-1 et COX-2 en fonction de la concentration en nimésulide, ibuprofène et aspirine (n=3, * significatif pour p
Afin de vérifier note modèle, trois composés ont été testés sur les lymphocytes et les monocytes. Pour les anti-inflammatoiresanti-inflammatoires non spécifiques, nous avons choisi l'aspirine et l'ibuprofèneibuprofène, et pour la moléculemolécule inhibitrice préférentielle de la COX-2 par rapport à la COX-1, nous avons pris le nimésulide (fig. 83). Nous avons tout d'abord vérifié par le test de lactatelactate déshydrogénase que ces trois produits n'étaient pas cytotoxiquescytotoxiques (COX-2, nous avons voulu vérifier que la présence dans le milieu d'un inhibiteur de la cyclooxygénase n'avait pas d'influence sur la transcription et la traduction de cette enzyme. Pour cela nous avons incubé les lymphocytes et les monocytes avec chacun des trois composés à deux concentrations et nous avons vérifié par western blotwestern blot la présence de la COX-2 (fig. 84).
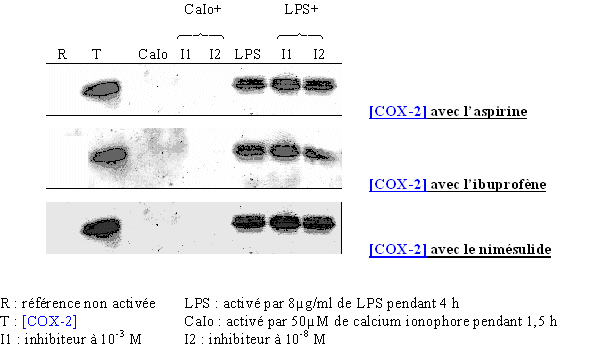
fig. 84 : Vérification de la transcription et de la traduction de COX-2 en présence de l'aspirine, de l'ibuprofène et du nimésulide.
Les résultats sont identiques pour les trois inhibiteurs. La COX-2 est absente pour une référence non activée, elle est également indétectable dans tous milieux activés par le calcium ionophore, ce qui valide les mesures de CI50 que nous avons obtenues par la suite en ce qui concernent COX-1. Dans les cas de stimulation par le LPS, la COX-2 a été détectée dans chaque milieu, ce qui montre que l'aspirine, l'ibuprofène et le nimésulide n'ont pas d'effet sur la transcription et la traduction de cette enzyme.
Donc, l'inhibitioninhibition de la production de TxB2 qui sera vue par la suite n'est pas due à une diminution de la quantité d'enzyme, comme on peut le constater avec un corticoïde, mais bien à une inhibition de l'activité enzymatique de la COX-2.
L'activité enzymatique des cyclooxygénases est fonction de la quantité de TxB2 produit, 0% d'activité correspond à une inhibition totale de la cyclooxygénase concernée. Pour les trois composés, les courbes montrent une inhibition qui se fait de manière concentration dépendante. Nous avons pu calculer les CI50 pour chaque produit et les ratios de sélectivité CI50 COX-2/ CI50 COX-1 correspondants (fig.85).

fig. 85 : Valeurs de CI50 en µM pour la COX-1 et la COX-2 humaine pour l'aspirine, l'ibuprofène et le nimésulide (n=3).
L'aspirine et l'ibuprofène ont une CI50 qui est plus favorable à COX-1, ce qui confirme que ces deux médicaments ne sont pas des inhibiteurs spécifiques de la COX-2.
Le nimésulide a pour sa part une CI50 inférieure envers COX-2 et le ratio de sélectivité que nous avons calculé est de 0,01, ce qui confirme ici aussi que le nimésulide est un inhibiteur de la COX-2 par rapport à la COX-1.
Par ces résultats qui sont comparables à ceux habituellement publiés, nous avons montré que notre modèle était au point pour calculer des constantes d'inhibition pour des molécules originales.
2.6.5. TEST DE MOLECULES ORIGINALES
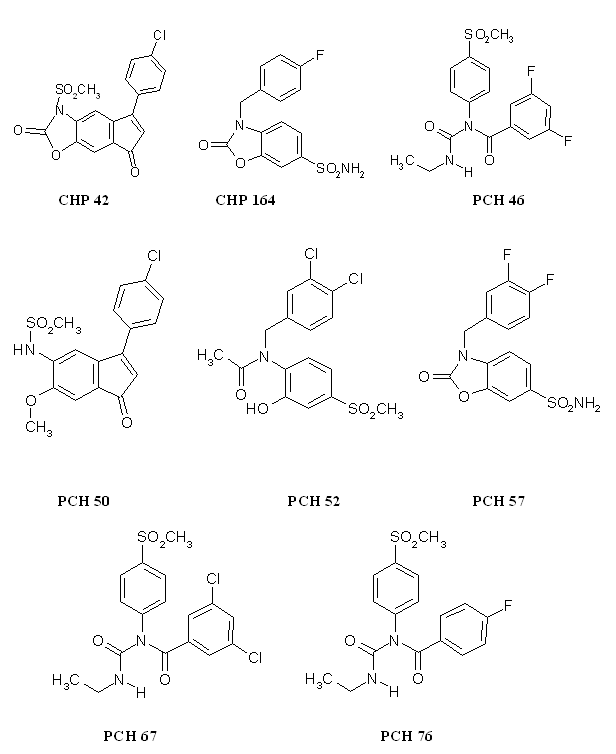
Nous avons testé 9 composés originaux provenant de l'ICPAL, ces molécules ont été synthétisées par l'équipe du Professeur Daniel Lesieur (fig. 86).
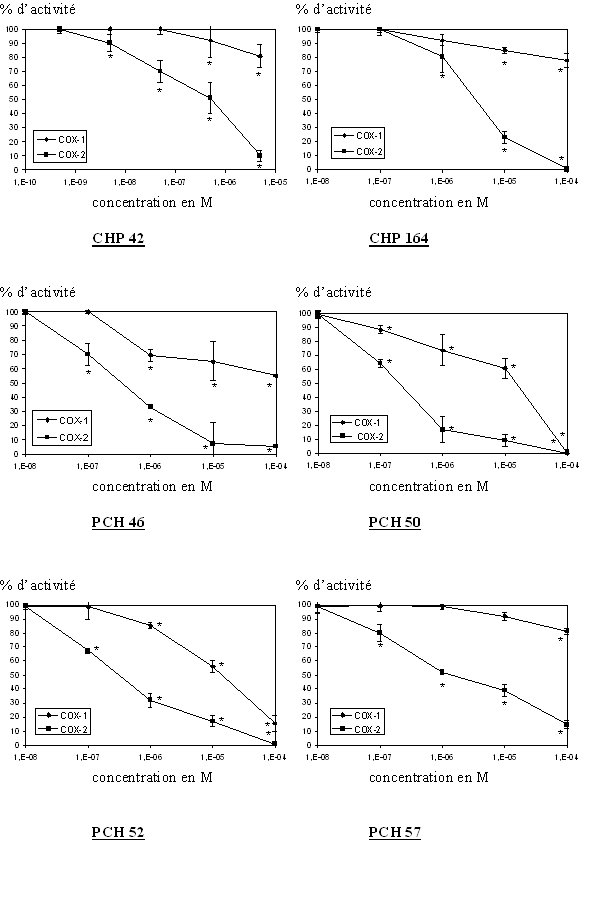
fig. 86 : Activité enzymatique de COX-1 et COX-2 en fonction des molécules originales testées (n=3, * significativement différent par rappport à la référence pour p
La première étape a consisté à solubiliser les différentes molécules. Elles se sont avérées insolubles dans les solvantssolvants organiques compatibles avec une absence de cytotoxicité vis à vis de la cellule. Nous avons réussi à les solubiliser dans le polysorbate 20.
Afin de vérifier la bonne tenue de la solubilité une fois que le tampon servant aux incubations est ajouté, nous avons comparé les spectresspectres UVUV-visible obtenus avant et après centrifugation de chacune des solutions. Seul le PCH 72 s'est montré insoluble dans le Montanox et dans le polysorbate 80, il est soluble dans le DMSO mais reprécipite lorsque nous ajoutons le tampon Hank's HEPES, nous n'avons donc pas pu tester ce composé.
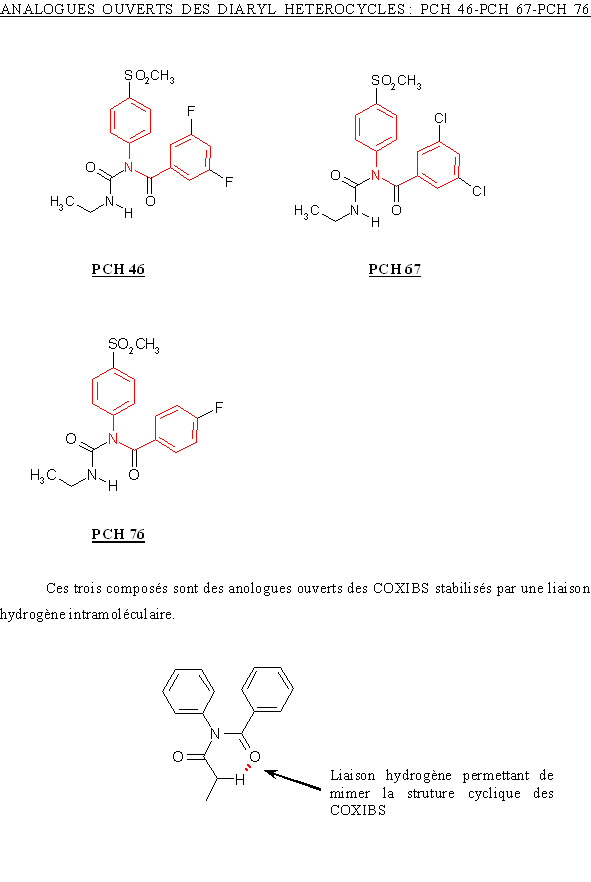
Toutes les autres molécules, à savoir le CHP 42, le CHP164, le PCH 46, le PCH 50, le PCH 52, le PCH 57, le PCH 67 et le PCH 76 ont pu être testés selon le protocole mis au point.
La deuxième précaution à prendre concerne la toxicitétoxicité de ces composés par rapport aux membranes plasmiques des lymphocytes et des monocytes. Pour chacun d'entre eux, nous avons pratiqué un test de lactate déshydrogénase. Nous n'avons pas trouvé de produit qui altérait l'intégritéintégrité de la membrane cellulairemembrane cellulaire, donc aucun n'est cytotoxique dans les conditions de notre expérimentation.
Une autre précaution est à prendre, il faut en effet s'assurer que les produits servant à solubiliser les molécules n'intéragissent pas avec notre modèle. Pour cela les lymphocytes et les monocytes ont été incubés en présence de polysorbate 20 aux concentrations présentes lors du test des composés originaux, et ceci avec les conditions normalesconditions normales. Nous avons pu constater que la quantité de thromboxane B2 produit par COX-1 ou par COX-2 n'est pas influencée par la présence de polysorbate 20.
Nous avons souhaité effectuer une autre vérification. Comme nous l'avions fait dans le cas des molécules de référence, nous avons voulu voir si nos composés originaux n'influençaient pas l'induction de la synthèse de la COX-2. Grâce à la technique de western blot nous avons pu constater que la transcription et la traduction de la COX-2 se faisaient normalement en présence de chacun des produits testés. Donc, si nous constatons par la suite une inhibition de la production de TxB2, nous pourrons affirmer que cette diminution est due à une inhibition de l'activité enzymatique de la cyclooxygénase et non pas à un effet type corticoïde des molécules originales.
Pour chaque molécule testée, nous pouvons noter une inhibition de la production de TxB2 par la COX-2, ces inhibitions se font toutes de manière concentration dépendante et l'activité enzymatique est nulle pour les concentrations en produits les plus importantes. De ces graphiques, il nous a été possible de calculer les CI50 correspondantes à chaque molécule, les valeurs sont résumées dans un tableau (fig. 86) et seront discutées par la suite.
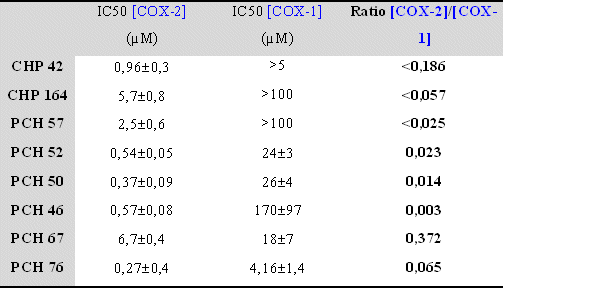
Tableau récapitulatif des valeurs de CI50 pour COX-1 et COX-2 pour chaque molécule originale.fig. 87 :
Dans le cas de la COX-1, les résultats sont plus difficilement interprétables car plusieurs molécules n'ont pas pu donner lieu à un calcul de CI50 car la valeur est trop élevée pour être déterminée, il s'agit du CHP 42, du CHP 164 et du PCH 57. Il ne nous a pas été possible d'augmenter la concentration car la solubilité des composés en question n'est pas suffisante.
Pour d'autres composés, les valeurs calculées l'ont été en extrapolant la courbe existante, c'est le cas du PCH 46 et du PCH 67. Enfin, pour les molécules restantes, c'est à dire le PCH 50, le PCH 52 et le PCH 76, les valeurs données sont celle calculées directement à partir de la courbe obtenue, l'inhibition se fait de façon concentration dépendante et elle est totale pour les concentrations les plus élevées. Les valeurs de CI50 de COX-1, ainsi que les ratios qui ont pu être établis, seront comparées avec celles obtenues pour la COX-2 dans la discussion et ce en prenant en compte la structure chimique de chacun des composés afin d'essayer d'établir un certain nombre de relations structure-activité.