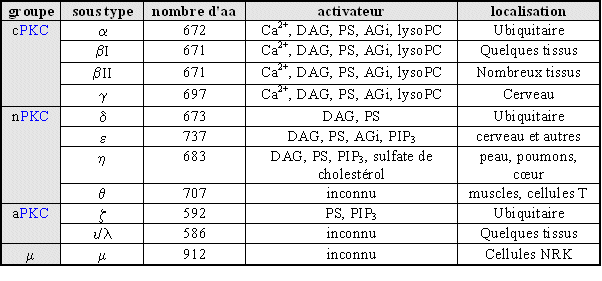
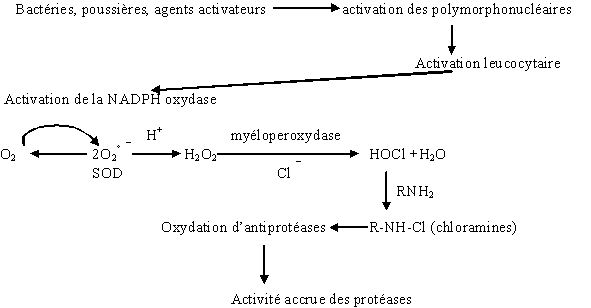
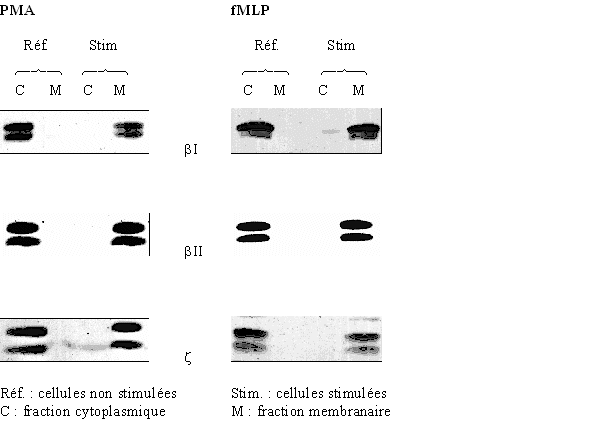
au sommaire
Schémas d'activation de la protéine Kinase C
De façon générale, les voies de signalisation interagissent les unes avec les autres pour aboutir à une réponse finale qui dépend de l'implication de chacune d'entre elles dans le réseau ainsi formé. Les principaux mécanismes permettant la transmission d'un signal sont : des interactions protéineprotéine-protéine, des phosphorylationsphosphorylations ou des déphosphorylations de protéines et la production ou la dégradation de protéines qui serviront par la suite de messagers intracellulaires. Il existe deux moyens pour que différentes voies interagissent entre elles : la production d'un second messager par une voie, ce qui en activera une autre ; ou une enzyme, régulée par une voie, dépendante de son substratsubstrat qui est produit par une autre voie (Bhalla U.S., Iyengar R., 1999).
1.3.1. VOIES D'ACTIVATION
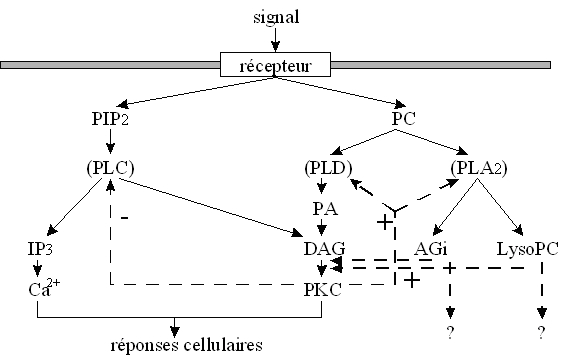
Toutes les voies d'activation de la [protéine kinasekinase C] ne sont pas encore clairement définies. Nous allons toutefois décrire les trois principales voies explicitées actuellement : la voie de la phospholipase C, la voie de la phospholipase D et la voie de la phospholipase A2 (fig. 10). Il faut néanmoins prendre en compte la complexité du réseau des signaux intracellulaires et voir ainsi que ces trois voies sont dépendantes les unes des autres (fig.11). Quelle que soit l'origine de la stimulationstimulation de la [protéine kinase C], il est à remarquer qu'au cours de son activation, cette enzyme migre du cytoplasmecytoplasme vers la membrane plasmiquemembrane plasmique : cette translocationtranslocation est indispensable pour que l'enzyme acquiert sa compétence catalytique. Certains travaux ont montré qu'il existe également une translocation vers la membrane nucléaire, mais sa fonction n'est pas clairement définie. Pour que ce changement de localisation ait lieu, le diacylglycérol semble jouer un rôle primordial ; en effet, quelle que soit la voie d'activation utilisée, ce second messager est toujours présent dans la boucle de régulation (Nishizuka Y., 1995).
En plus de ces voies de régulation, la [protéine kinase C] est stabilisée par d'autres protéines qui sont différentes selon la localisation de la [PKC]. Les connaissances portant sur ces protéines d'ancrage et leur rôle sur la compétence catalytique de l'enzyme seront décrits dans ce chapitre.
Les hypothèses concernant un autre processus nécessaire à l'activité de la [protéine kinase C] seront également détaillées : il s'agit de modifications posttranscriptionnelles et plus particulièrement des phosphorylations subies par l'enzyme au cours de sa maturation. Les protéines d'ancrage pourraient avoir une fonction sur la déphosphorylation de la [protéine kinase C] et donc sur sa rétroinhibition.
![fig. 10 : Représentation hypothétique des signaux conduisant à l'activation de la [PKC] fig. 10 : Représentation hypothétique des signaux conduisant à l'activation de la [PKC]](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/817_siomboing10.gif)
fig. 10 : Représentation hypothétique des signaux conduisant à l'activation de la [PKC]
Ces phénomènes qui régissent l'activation de la [PKC] dépendent tous les uns des autres et peuvent conduire à la stimulation d'une même protéine, montrant la complexité de la régulation des signaux au niveau de la cellule, mais également la difficulté à agir sur un facteur sans influer sur les autres.
![fig.11 : Réseau possible des signalisations intracellulaires impliquant la [PKC] (Nishizuka., 1995) fig.11 : Réseau possible des signalisations intracellulaires impliquant la [PKC] (Nishizuka., 1995)](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/817_siomboing11.gif)
fig.11 : Réseau possible des signalisations intracellulaires impliquant la [PKC] (Nishizuka., 1995)
1.3.1.1. Voie de la phospholipase C
Un ligand (hormonehormone, peptide ou neurotransmetteurneurotransmetteur...) se fixe sur un récepteur formé de 7 hélices transmembranaires; une boucle intracellulaire permet la stimulation de la protéine Gprotéine G. L'activation de cette protéine entraîne la formation d'un complexe protéique permettant un contrôle de la cellule sur la durée de cette activation, les compartiments cellulaires visés ainsi que le type de signal à transmettre à l'intérieur de la cellule (Zuker C.S., Ranganthan R., 1999).
Ce complexe protéique est formé de protéines adaptatrices (comme les arrestines), qui jouent un rôle dans la désensibilisationdésensibilisation des voies de signalisation liées aux protéines G, permettant le recrutement de tyrosinetyrosine kinases non réceptorielles par l'intermédiaire des domaines SH3 (Lutrell L.M. et al., 1999), de protéines escortes impliquées dans la synthèse de nouvelles protéines (Mc Latchie L.M. et al., 1998), de protéines d'échafaudageséchafaudages comme NHERF/EBP50.
Ceci permettraient l'existence de voies de signalisation alternatives indépendantes des voies classiques (Cao TT.T. et al., 1999), des petites protéines G comme ARF ou RHO assurant un rôle sur le remodelage du cytosquelettecytosquelette ainsi que sur le transport vésiculaire (Haga K. et al., 1998).
Les complexes peuvent également être formés par un dimère de protéine G (Jordan B.A., Devi L.A., 1999) conduisant à des propriétés distinctes par rapport à celles déjà observées, ceci a été obtenu grâce à l'emploi d'une technique récente utilisant le phénomène de transfert d'énergie bioluminescente de résonance (BRET) (Angers S. et al., 2000).
De façon classique, la protéine G activée fixe un GTPGTP sur sa sous-unitésous-unité α, ceci permet l'activation des isoformes β1, β2 et β3 de la phospholipase C (PLCPLC); cette activation peut se faire, dans une moindre mesure, par un dimère formé des sous-unités β et γ de la protéine Gi (Smrcka A.V. et al., 1991, Clapham D.E., Neer E.J., 1993). L'activation des isoformes γ1 et γ2 de la PLC se fait essentiellement par les récepteurs tyrosine kinase, la stimulation de l'isoforme δ n'est pas encore définie. La phospholipase C va à la membrane lorsque son substrat est présent.
![fig. 12 : Modèle d'activation de la [protéine kinase C] par la phospholipase C fig. 12 : Modèle d'activation de la [protéine kinase C] par la phospholipase C](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/817_siomboing12.gif)
fig. 12 : Modèle d'activation de la [protéine kinase C] par la phospholipase C
Le phosphatidylinositol (PIPI), qui est en très faible quantité dans la membrane, joue un rôle important dans les phénomènes de signalisation. Il peut être phosphorylé par une PI kinase pour former le phosphatidylinositol-4-phosphatephosphate (PIP) qui peut à son tour être phosphorylé par la PIP kinase pour donner le phosphatidylinositol-4,5-diphosphate. La phospholipase C peut hydrolyser ces différents produits, mais pas le phosphatidylinositol-3,4,5-triphosphate (PIP3). Le substrat de la PLC est hautement influencé par la présence d'autres lipideslipides. Il en résulte une production de diacylglycérol et d'inositol-1,4,5-triphosphate (IP3). Ce dernier interagit avec un récepteur spécifique sur la membrane du réticulum endoplasmiqueréticulum endoplasmique, ce qui permet l'ouverture de canaux et entraîne ainsi la libération de calciumcalcium contenu dans des vésicules. Ce calcium agit en parallèle avec le diacylglycérol dans le but d'activer la [protéine kinase C] (fig.12). Le DAG produit par cette voie est rapidement transformé en acideacide phosphatidique (PA) suite à l'action de la DAG kinase (NewtonNewton A.C., Johnson J.E., 1998).
1.3.1.2. Voie de la phospholipase D
La phospholipase D (PLD) permet la dégradation de la phosphatidyl cholinecholine (PCPC) en choline et en acide phosphatidique qui est transformé en diacylglycérol par la phosphomonoestérase.
La concentration en DAG reste élevée plus longtemps que lorsque celui-ci est produit par la voie de la PLC.
L'explication de ce résultat est que les deux diacylglycérols produits sont différents par leurs fonctions acyles (tout en étant capables d'activer la [PKC]) et celui obtenu par la voie de la PLD est un mauvais substrat pour la DAG kinase. Par contre, la dégradation du diacylglycérol, par la DAG lipase, se fait plus lentement. Il semblerait que la DAG kinase et la DAG lipase soient régulées par la quantité de diacylglycérol présente dans la cellule (Boarder M.R., 1994).
Il semblerait également que certains activateurs de la [PKC] (estersesters de phorbol, DAG inséré dans la membrane et calcium) puissent stimuler la PLD. Il est à noter que certaines isoformes de la [protéine kinase C] (α et βI) soient capables d'activer la phospholipase D par l'intermédiaire d'une protéine G de la famille ARF (ADPADP ribosylation factor). Ceci expliquerait l'activité plus longue de la PLD (Khan R.A. et al ., 1993).
L'activation de la phospholipase D peut également se faire par la formation d'un complexe constitué d'un récepteur à protéine G couplé à une petite protéine G de type Rho ou ARF, échappant ainsi au contrôle classique par l'intermédiaire d'une protéine G hétéro-trimérique (Okamoto T. et al., 1998).
1.3.1.3. Voie de la phospholipase A2
Cette enzyme est composée de plusieurs isoformes qui peuvent être cytosoliques, membranaires et sécrétoires. Elle permet l'hydrolysehydrolyse des phospholipidesphospholipides sur leur position sn2, libérant ainsi des acides grasacides gras cis insaturés. Ces acides, en présence de DAG ou d'esters de phorbol, permettent l'activation de la [PKC]. L'un d'entre eux est l'acide arachidonique qui est le précurseur pour la formation de leucotriènes par la lipooxygénase et des prostaglandinesprostaglandines par la [cyclooxygénase]. L'origine de l'activation de la PLA2 se fait par l'intermédiaire d'un récepteur couplé à une protéine G.
Il existe une isoforme cytosolique de 85 kDa, elle est phosphorylable par une MAP kinase sur une séquence spécifique et peut ensuite se coupler à la membrane en présence de calcium. A ce stade, elle acquiert son activité catalytique (Flint A.J. et al., 1990).
D'autres isoenzymes indépendantes du calcium sont connues mais leur sélectivité vis-à-vis des acides gras et leur mécanisme d'activation ne sont pas déterminées.
1.3.2. LOCALISATION DE LA [PKC] ET PROTEINES D'ANCRAGE
Comme de nombreuses protéines, la [PKC] est capable de se lier à d'autres protéines, sans pour autant que ces dernières soient substrats de la kinase (Csukai M. and Mochly-Rosen D., 1998).
Ainsi, en réponse à son activation, la [protéine kinase C] est transloquée vers la membrane plasmique. A ce niveau, plusieurs protéines ont été caractérisées comme protéine d'ancrage, parmi lesquelles RACK (receptor for activited C kinase) ; elle a une massemasse moléculaire allant de 30 à 36 kDa. Elle est capable de fixer la [PKC] lorsque celle-ci est sous sa forme activée mais ne peut pas fixer cette enzyme sous sa configuration inactive. RACK sert uniquement à stabiliser la [protéine kinase C] et par là même à augmenter son activité enzymatiqueenzymatique (Csukai M. et al., 1997).
La liaison se fait par le domaine C2 de la [PKC] et par une région de la protéine d'ancrage appelée RBS (RACK binding site). Les mécanismes régissant la reconnaissance et la fixation ne sont pas encore connus ; il semblerait toutefois que cette liaison favoriserait l'accessibilité du substrat (fig.13).
D'autres protéines de liaison à la [protéine kinase C] ont depuis été décrites. La PICK (perinuclear interacting C kinase) a la possibilité de se coupler à la [PKC] au niveau de la membrane nucléaire. Une troisième espèceespèce a été découverte, il s'agit de l'AKAP (A kinase anchoring protein) qui possède une masse de 79 kDa. Elle a la particularité de se fixer à la fois aux structures subcellulaires et au domaine régulateur de la [protéine kinase C]. A ce stade, la [PKC] est sous sa forme inactive; la possibilité que cette protéine d'ancrage puisse déphosphoryler la [protéine kinase C] et donc de l'inactiver n'est pas exclue (Mochly Rosen D. et al., 1991).
La région V5 permet de différencier les isoformes βI et βII de la [protéine kinase C]. Le gènegène [PKC] β peut subir, lors de sa transcriptiontranscription, deux épissagesépissages alternatifs distincts et spécifiques de l'une ou l'autre des isoformes. Cette région V5 a pour rôle de contrôler la localisation des deux isoformes. En effet, il a été montré, dans des cellules humaines U937, que l'isoforme βI est localisée au niveau des microtubules, tandis que l'isoenzyme βII se trouve dans des granules sécrétoires. Cette différenciation est uniquement due à des interactions protéine-protéine mettant en jeu la région V5 (Kiley S. et Parker P.J., 1995).
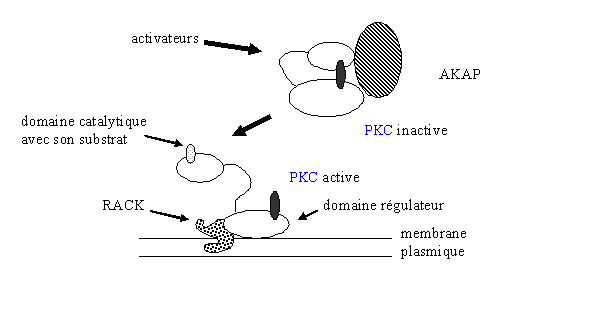
fig. 13 : relations entre l'activité de la PKC et ses protéines d'ancrage.
1.3.3. IMPORTANCE DE LA PHOSPHORYLATION DE LA PKC
En réponse à la synthèse de la [protéine kinase C], il apparaît qu'une modification posttranscriptionnelle comme la phosphorylation est primordiale pour permettre une activation par le diacylglycérol. Plusieurs sites de phosphorylation ont tout d'abord été décrits sur le domaine régulateur, sur le domaine catalytique et sur la région V3 qui sert de charnière entre les deux (Flint A.J. et al., 1990).
Ces modifications posttranscriptionnelles permettraient de modifier la structure tridimensionnelle de l'enzyme et ainsi d'obtenir une éventuelle régulation (Zhang J. et al., 1994).
Une première hypothèse émise a été de considérer ces différentes possibilités de phosphorylation comme un moyen d'obtenir des [PKC] différentes en faisant varier les spécificités vis-à-vis des substrats potentiels (Gschwendt M. et al., 1994).
Assez rapidement, l'idée d'autophosphorylation est apparue comme nécessaire pour avoir une enzyme active et que seules les phosphorylations intervenant sur le domaine catalytique avaient une influence sur les propriétés de l'enzyme (Azzi A. et al., 1992).
En effet, la phosphorylation altérerait l'affinité pour les esters de phorbol, augmenterait l'affinité pour le calcium et influerait sur l'association de l'enzyme avec la membrane. Ceci permettrait également une régulation négative car la [PKC] phosphorylée serait plus sensible aux protéolysesprotéolyses.
Par la suite, d'autres études ont permis de montrer que la phosphorylation de certains résidus d'acides aminésacides aminés avait une influence sur la solubilité dans les détergents ainsi que sur la mobilité électrophorétique (Zhang J. et al., 1994).
Par ailleurs, il est confirmé que la phosphorylation sur le domaine régulateur et sur le coude (région V3) n'ont pas d'effet détectable sur les propriétés de la [PKC]. Une nouvelle hypothèse est avancée : il existerait une kinase qui effectuerait la première phosphorylation de la [protéine kinase C]. Cette idée est issue d'une constatation : certains sites phosphorylés ne peuvent pas l'être par la [PKC] elle-même, car cela lui demanderait une trop grande flexibilité.
Afin de mieux comprendre le rôle de ces phosphorylations, des études en biologie moléculairebiologie moléculaire ont été effectuées. Trois sites de phosphorylation ont été confirmés sur le domaine catalytique avec des séquences ayant de fortes homologieshomologies entre les différentes isoformes. Il est à noter que l'écart séparant les différents groupements phosphates est toujours le même (Keranen L.M. et al., 1995) (fig. 14).
![fig.14 : Sites de phosphorylation conservés sur le domaine catalytique de la [protéine kinase C] fig.14 : Sites de phosphorylation conservés sur le domaine catalytique de la [protéine kinase C]](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/817_siomboing14.gif)
fig.14 : Sites de phosphorylation conservés sur le domaine catalytique de la [protéine kinase C]
Par la suite, différentes études ont essayé de définir les conditions de phosphorylation propres à l'une ou l'autre des isoformes de la [PKC]. Ainsi il a été découvert qu'une kinase, la PDK 1 (phosphoinositide dependent kinase 1), déjà connue pour phosphoryler d'autres kinases sur des résidus thréoninethréonine, est capable d'avoir comme substrat les isoformes ζ et δ de la [protéine kinase C]. Ces phosphorylations ont lieu sur les positions Thr 410 et Thr 505, et sont capables à elles seules d'activer l'enzyme, en libérant le site catalytiquesite catalytique, lorsque les cellules concernées sont elles-mêmes stimulées (Le Good J.A. et al., 1998).
D'autres études plus complètes ont permis d'expliquer certains mécanismes pour d'autres isoformes. Trois cas vont maintenant être décrits : tout d'abord les isoformes βII et α où les conditions de phosphorylation et les conséquences que cela implique pour l'enzyme seront détaillées, ensuite le cas de l'isoforme ε et de son réseau de signalisation incluant d'autres isoformes de la [PKC] seront explicités.
1.3.3.1. [protéine kinase C] βII
La translocation et l'activation de la [PKC] βII sont précédées d'une série de trois phosphorylations. Les trois sites connus sont une thréonine en position 500 et en 641 et une sérinesérine en position 660 (Keranen L.M. et al., 1995). Le précurseur de [PKC] βII a une masse moléculaire apparente de 74 kDa et passe à 80 kDa lorsque l'enzyme est mature. La présence du groupement phosphate sur la position 500 n'est pas due à une autophosphorylation, il semblerait qu'une kinase (non déterminée) intervienne à ce niveau. Ceci entraîne la présence de charges négatives, impliquant des interactions électrostatiquesélectrostatiques avec Lys 489, Arg 465 et Asp 466 (Orr J.W., Newton A.C., 1994), qui sont des acides aminés situés dans le site catalytique.
La présence de cette première phosphorylation permet à l'enzyme d'acquérir une compétence pour conduire deux autophosphorylations. La première, qui a lieu sur la Thr 641, permet à l'enzyme de posséder une compétence catalytique. En effet, cette modification est indispensable pour que l'enzyme puisse fixer le substrat, en lui permettant de stabiliser sa conformationconformation active. Une deuxième autophosphorylation peut ensuite avoir lieu sur la Ser 660; elle n'a pas d'implication directe sur l'activité enzymatique, mais permet une interaction entre le site catalytique et l'extrémité C-terminale de la protéine.
Cette modification conformationnelle permet de réguler la localisation subcellulaire. En effet, il a été constaté que suite à ces modifications, l'enzyme se sépare du cytosquelette (fig. 15). D'autre part, il a été remarqué, lorsque cette troisième modification est présente, la [protéine kinase C] devient soluble dans les détergents, ceci pourrait faciliter sa liaison à la membrane plasmique.
![fig. 15 : Modèle montrant l'implication des phosphorylations sur l'activité enzymatique de la [protéine kinase C] βII (Keranen L.M. et al., 1995). fig. 15 : Modèle montrant l'implication des phosphorylations sur l'activité enzymatique de la [protéine kinase C] βII (Keranen L.M. et al., 1995).](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/817_siomboing15.gif)
fig. 15 : Modèle montrant l'implication des phosphorylations sur l'activité enzymatique de la [protéine kinase C] βII (Keranen L.M. et al., 1995).
1.3.3.2. [protéine kinase C] α
Les premières études ont montré que l'isoforme α de la [PKC] subissait sur le domaine catalytique une première phosphorylation par l'intermédiaire d'une autre kinase, ce qui entraîne une autophosphorylation sur un deuxième site (Cazaubon F . et al., 1994).
Selon le degré de phosphorylation la migration électrophorétique varie, la masse moléculaire apparente passant de 74 kDa à 80 kDa. Il est apparu également la présence obligatoire d'une charge négative sur le site catalytique afin que l'enzyme puisse jouer son rôle.
Par la suite, les sites phosphorylables ont été définis : Thr 497, Thr 638 et Ser 657. Le site Thr 497 doit être phosphorylé pour que l'enzyme ait une compétence catalytique. Par contre, Thr 638 n'est pas essentielle pour avoir l'activité catalytique, mais l'absence de phosphate influe sur la solubilité de la protéine, ce qui augmente sa sensibilité à l'oxydationoxydation, à l'action des phosphatases entraînant l'inactivation de la [protéine kinase C].
De plus, la phosphorylation de Thr 638 provoque une conformation fermée de la protéine, améliorant sa résistancerésistance à la dégradation et impliquant une durée d'action de l'enzyme plus importante (Bornancin F., Parker P.J., 1996).
Cette conformation est due aux interactions existantes, grâce aux groupements phosphates, entre l'extrémité C-terminale et le site catalytique (fig.16). La phosphorylation de Thr 638 permettrait également de protéger un résidu d'acide aminé (Cys 499), se trouvant sur le site catalytique, et qui pourrait subir une oxydation qui entraînant ainsi l'inactivation de l'enzyme.
![fig. 16 : Importance des phosphorylations sur la conformation de la [protéine kinase C] α (Bornancin F ., Parker P.J., 1996). fig. 16 : Importance des phosphorylations sur la conformation de la [protéine kinase C] α (Bornancin F ., Parker P.J., 1996).](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/817_siomboing16.gif)
fig. 16 : Importance des phosphorylations sur la conformation de la [protéine kinase C] α (Bornancin F ., Parker P.J., 1996).
Un troisième site de phosphorylation est connu : c'est la Ser 657. Ce site n'a pas d'influence significative sur l'activité enzymatique, mais permet d'accroître la résistance aux phosphatases en bloquant plus fortement la conformation fermée de la [protéine kinase C].
1.3.3.3. PROTEINE KINASE C ε
L'activation de la [PKC] ε peut être faite par l'intermédiaire de la phospholipase C γ ou de la phosphatidylinositol kinase, elle provoque alors une phosphorylation de l'enzyme. Ensuite, cette isoforme a la possibilité de stimuler d'autres voies de signalisation comme la voie des MAP kinases ou l'isoforme ζ de la [protéine kinase C] (Moriya S. et al., 1996); certaines hypothèses disent que des gènes de transcription et la [PKC] µ pourraient également être des cibles de la [PKC] ε (Razin E. et al., 1994).
![fig. 17 : Schéma hypothétique sur le réseau de transmission d'informations impliquant plusieurs isoformes de la [protéine kinase C] fig. 17 : Schéma hypothétique sur le réseau de transmission d'informations impliquant plusieurs isoformes de la [protéine kinase C]](https://cdn.futura-sciences.com/cdn-cgi/image/width=1024,quality=60,format=auto/sources/images/dossier/rte/817_siomboing17.gif)
fig. 17 : Schéma hypothétique sur le réseau de transmission d'informations impliquant plusieurs isoformes de la [protéine kinase C]
Une fois activée par la [PKC] ε, l'isoforme ζ peut avoir elle-même plusieurs fonctions. Ainsi, il a été remarqué que cette enzyme intervient dans la régulation de la synthèse de l'ADNADN et peut également agir sur la transcription de certains gènes par la voie Ras (Berra E. et al., 1993).
Lors de l'activation de cette isoforme, deux translocations sont possibles : une classique vers la membrane plasmique et une autre vers la membrane nucléaire ; les mécanismes contrôlant ces deux possibilités ne sont pas connus (Wooten M.W. et al., 1997).
A la vue de ces données, il a été montré qu'une isoforme de la [PKC] est, en partie, sous le contrôle d'une autre. A partir de là, certaines hypothèses ont été émises : il existerait une cascade dans laquelle l'activation d'une isoforme de la [protéine kinase C] pourrait se faire par une autre isoforme et ceci de façon hiérarchique (Kampfer S. et al., 1998) (fig.17).
1.3.3.4. RETROCONTROLE DE LA PROTEINE KINASE C
Lors d'une activation prolongée de cellules par les esters de phorbol, il a été constaté que la [PKC] perdait son activité aussi bien au niveau cytoplasmique qu'au niveau membranaire. Ceci montre que cette enzyme subit une régulation négative. Deux mécanismes la régissent : l'un est une dégradation de la protéine par des protéasesprotéases, l'autre est une diminution de la synthèse de la PKC. Il semblerait que le processus de protéolyse ait une certaine sélectivité et que les isoformes préférentiellement lysées varient en fonction du type cellulaire et du second messager intervenant lors de l'activation de l'isoenzyme concernée.
Un autre élément est apparu : les enzymes étant sous la conformation active sont plus sensibles à l'action des protéases, ceci serait en faveur d'une hypothèse portant sur la déphosphorylation de l'enzyme par des phosphatases et confirmerait donc une possible action déphosphorylante de la protéine AKAP, qui est une protéine d'ancrage dans le cytosquelette pour la PKC sous sa conformation inactive.
Ce mécanisme présenterait l'avantage de pouvoir disposer plus rapidement de la PKC pour une nouvelle activation (Wilkinson S.E., Nixon J.S., 1998).