au sommaire
- À lire aussi
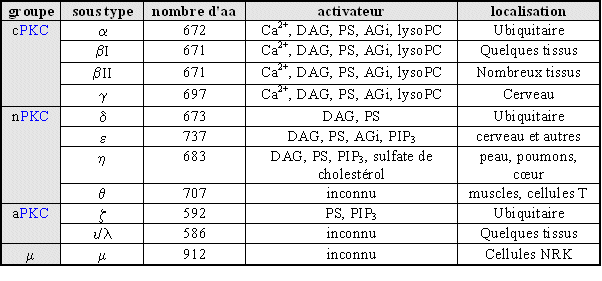
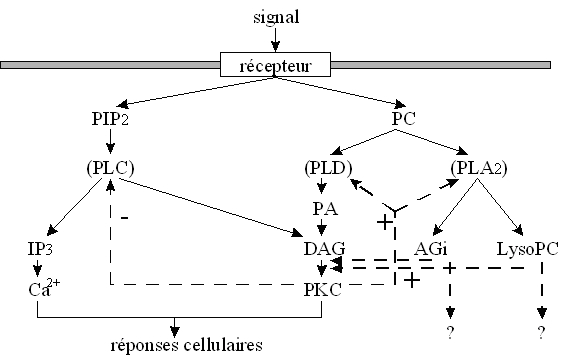
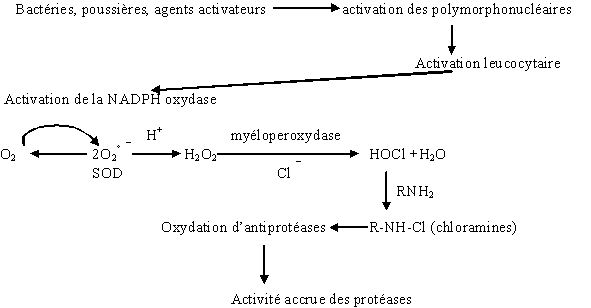
La protéineprotéine kinasekinase C fait partie d'une cascade de stimulationsstimulations afin d'activer une protéine (la NADPH oxydase), en la phosphorylant, pour permettre une réponse cellulaire. Ce schéma de régulation est très répandu dans l'organisme, et donc explique une grande diffusion de cette enzyme et son importance biologique (Bhalla U.S. et Ivengar R., 1999, Caponigro F. et al., 1997).
Il y a un côté néfaste à ce système : dans le cas d'une activation trop importante, la dérégulation provoquée peut avoir des conséquences fâcheuses pour la réponse cellulaire. En raison de sa grande distribution, il est de plus difficile d'inhiber spécifiquement une seule isoenzyme sans modifier l'action des autres; ceci est d'autant plus vrai que les outils pharmacologiques habituellement utilisés ne sont pas forcément spécifiques de l'enzyme étudiée.
En effet, les esters de phorbol couramment pris comme activateurs de la protéine kinase C sont capables d'activer d'autres enzymes impliquées dans l'activation de la NADPH oxydase,comme les protéines chimacrine α et β, RAS-GRP et UNC-13 (Caloca M.J. et al., 1997, Ebinu J.O. et al., 1998, Kazanietz M.G. et al., 1995).
Ceci implique de développer une nouvelle stratégie afin d'étudier des inhibiteurs potentiels de la PKC sur le modèle de la flambée respiratoire chez le granulocytegranulocyte neutrophileneutrophile.
Dans cet objectif, notre étude est de mettre au point un modèle utilisant la flambée respiratoire chez les granulocytes neutrophiles et permettant de tester des molécules potentiellement inhibitrices de la protéine kinase C. Pour y parvenir, nous avons regardé la réponse de la PKC et son action face à une molécule, le chlorure de chélérythrine, qui est capable de l'inhiber de façon sélective. Notre but était de mettre en évidence une action directe du composé sur l'enzyme et si possible pouvoir visualiser une sélectivité pour une isoforme donnée; par ailleurs, nous voulions également avoir la possibilité de mesurer une éventuelle inhibitioninhibition au niveau cellulaire.
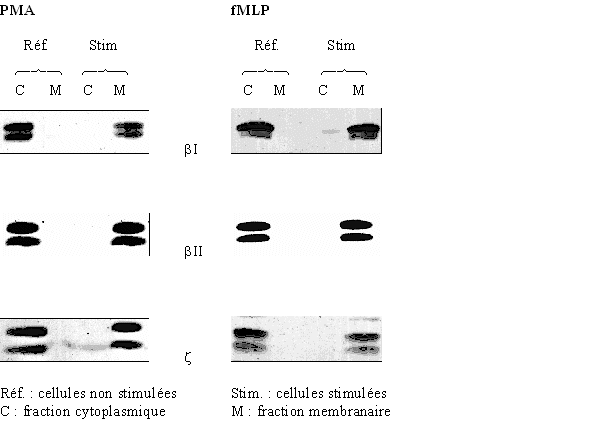
La protéine kinase C est transloquée du cytoplasmecytoplasme vers la membrane plasmiquemembrane plasmique lors de son activation (Nishizuka Y., 1998).
Nous avons utilisé cette propriété afin de définir les conditions optimales de stimulation de cette enzyme, ceci est visualisé par une technique de western blotwestern blot. Ainsi, les trois isoformes de la PKC peuvent être activées par le PMAPMA à 160 nM ou le fMLP à 1 µM. Ce résultat est confirmé en ce qui concerne les isoenzymes βI et βII (Wang J.P. et al., 1997), cependant d'autres études ont pu souligner une absence de déplacement intracellulaire pour l'isoforme ζ lors d'une activation par le PMA. La présence de cette translocationtranslocation a déjà été expliquée de la façon suivante : l'isoforme ζ aurait conservé un site ayant une faible affinité pour les esters de phorbol dans son domaine riche en cystéinecystéine, permettant ainsi une activation avec le PMA fortement concentré (Borner C.N. et al., 1992, Baldassare J.J. et al., 1992).
Une autre hypothèse peut être avancée : nous avons vu dans la première partie que certaines isoformes de la protéine kinase C pouvaient être activées par d'autres; notre modèle utilisant des cellules non modifiées, elles conservent donc toutes leurs propriétés, permettant aux isoenzymes βI et βII de phosphoryler éventuellement leur homologue ζ et donc de l'activer. Les études faites sur des cellules transformées génétiquement pourraient avoir perdu cette possibilité et donc ne permettraient pas de visualiser une activation de la PKC ζ par un ester de phorbol comme le PMA (Ron D. et Kazanietz M.G., 1999).
Afin de montrer une action de l'inhibiteur sur les granulocytes neutrophiles, nous avons cherché à voir l'activité antioxydante de la chélérythrine au niveau cellulaire. Il a tout d'abord fallu s'assurer de l'innocuité du chlorure de chélérythrine aux concentrations étudiées et de l'absence d'interaction directe entre cette molécule et l'anionanion superoxyde dosé. Ceci a été fait respectivement par un dosagedosage de l'activité de la lactatelactate déshydrogénase et par un modèle acellulaire, il en est ressorti que rien ne s'opposait à la poursuite de l'étude. L'activité antioxydante a été mise en évidence par un dosage d'anion superoxyde après stimulation des granulocytes neutrophiles par le PMA et le fMLP, dans les mêmes conditions que pour la translocation. Nous avons enregistré une CI 50 de 11,6.10-6 M ± 1,6 pour une activation avec le fMLP et de 21,1.10-6 M ± 2,1 lorsque c'est le PMA qui a servi d'activateur. Ces deux valeurs sont conformes avec les résultats obtenus dans d'autres études (Gopalakrshna R. et al., 1995) où l'intervalle habituel est de 10.10-6 M à 30.10-6 M selon le type de cellule et les conditions utilisées. L'écart entre les deux CI 50 est facilement explicable, le fMLP utilise une voie naturelle pour activer la PKC, tandis que le PMA active directement et spécifiquement l'enzyme, ce qui implique une activation plus forte avec une absence de contrôle de la cellule sur cette activité.
L'étape suivante pour la mise au point du modèle a été de purifier la protéine kinase C dans le but de pratiquer par la suite l'étude de liaison; ceci a été fait par chromatographiechromatographie sur DEAE-Sephacel. La présence des trois isoenzymes a été caractérisée par western blot.
Le but de cette étude de liaison est de confirmer que l'inhibition de la flambée respiratoire est due à une action du chlorure de chélérythrine sur la protéine kinase C, ce qui peut-être fait en montrant une diminution de la liaison d'un ester de phorbol ayant une haute affinité pour cette enzyme. Le ligandligand choisi est le phorbol-12, 13-dibutyrate. Pour mettre au point cette technique, nous avons, tout d'abord, cherché à mesurer la constante de dissociation (Kd) du ligand pour l'enzyme afin de la comparer aux valeurs habituellement publiées dans le but de valider notre technique. Le Kd mesuré d'après la méthode de Lineweaver et Burk est de 3,7.10-6 M, cette valeur est comparable à celle donnée dans d'autres études où elle est comprise entre 1.10-6 M et 5.10-6 M (Kazanietz M.G. et Blumberg P.M., 1996, Wender P.A. et al., 1995).
La différence relevée peut s'expliquer de plusieurs façons : les isoformes présentes dans chaque modèle peuvent varier; en outre, les conditions d'expérimentation peuvent présenter une variabilité entre deux études similaires. En additionnant l'inhibiteur au milieu, nous avons pu mettre en évidence une action directe de la chélérythrine sur la PKC. Nous avons, en effet, montré une diminution d'affinité pour le phorbol-12, 13-dibutyrate lorsque nous augmentons la concentration en inhibiteur. Cette étude de liaison nous a permis de calculer une CI 50 de 710.10-9 M 0,016. Cette valeur est plus faible que lors de la mise en évidence de l'activité antioxydante. Les deux premières valeurs de la constante d'inhibition correspondent en fait à la mesure de l'inhibition de la réponse cellulaire provoquée par la protéine kinase C ; or l'intérêt de ce type d'enchaînement de stimulations est d'amplifier un stimulus faible tout en obtenant une réponse élevée tandis que l'étude de liaison fait une mesure sur l'enzyme elle-même, ce qui implique une plus grande facilité d'inhibition. La valeur de CI 50 obtenue est équivalente à celle relevée dans d'autres études (Keenan C. et al., 1997) où la CI 50 est de 660.10-9 M.
Mais, ce résultat ne peut pas prouver à lui seul que c'est l'inhibition de la protéine kinase C qui a produit un effet anti-inflammatoireanti-inflammatoire dans notre modèle, car les esters de phorbol sont capables de se coupler avec d'autres protéines, comme les protéines chimacrine α et β, RAS-GRP et UNC-13, impliquées dans la production d'anion superoxyde.
Nous avons donc été obligés de développer une stratégie supplémentaire pour attribuer la diminution de la flambée respiratoire à une inhibition de la protéine kinase C. Comme nous l'avons déjà démontré, la protéine kinase C doit être transloquée vers la membrane plasmique afin d'acquérir son activité enzymatiqueenzymatique. Si nous sommes capables de montrer une inhibition de cette translocation, nous aurons par-là même montré l'inhibition de la PKC, ce qui pourra alors reforcer l'hypothèse selon laquelle les propriétés antioxydantes du chlorure de chélérythrine sont dues à une inhibition de la PKC.
Dans ce but, nous avons repris les conditions qui nous ont permis de montrer cette translocation, à savoir une activation des granulocytes neutrophiles avec le PMA à 160 nM pendant 5 minutes ou le fMLP à 1 µM pendant 10 minutes, en plus nous avons ajouté l'inhibiteur au milieu à deux concentrations : une faible (4 µM) et une forte (40 µM). Par rapport aux références sans chélérythrine, nous avons pu constater que la translocation a été conservée pour la plus petite concentration en composé, par contre dans le cas de l'emploi d'une concentration plus importante, l'enzyme reste localisée au niveau du cytoplasme montrant ainsi l'inhibition totale du déplacement intracellulaire des trois isoformes (βI, βII et ζ) de la protéine kinase C. En utilisant deux quantités différentes de molécule, nous avons également pu voir que cette inhibition était de type concentration dépendante. Nous avons ainsi montré qu'il était possible de voir une inhibition de la translocation de la PKC vers la membrane plasmique en utilisant la technique du western blot. La chélérythrine a montré qu'elle était capable de bloquer indifféremment le déplacement intracellulaire de chaque isoenzyme.
Dans cette première partie, nous avons prouvé que l'inhibition de la flambée respiratoire chez le granulocyte neutrophile par le chlorure de chélérythrine était dûe en partie à une inhibition de la protéine kinase C. Ceci a été prouvé d'une part en mesurant une diminution de la liaison entre un ester de phorbol et la protéine kinase C, et d'autre part en montrant l'inhibition d'une propriété liée à l'activation de cette enzyme, c'est à dire sa translocation du cytoplasme vers la membrane plasmique. De plus, notre modèle a la possibilité de mettre en évidence une action spécifique d'un composé pour l'une ou l'autre des trois isoformes de l'enzyme en utilisant des cellules non modifiées, dans ce cas, nous observerions des réponses différentes dans l'inhibition de la translocation de la protéine.
En outre, ces procédés sont facilement transposables à d'autres cellules et permettraient l'étude d'autres isoenzymes de la protéine kinase C dans des conditions similaires, car nous avons utilisé les propriétés intrinsèques de cette enzyme dans des cellules non transformées.
Maintenant que notre modèle est validé, nous pouvons l'exploiter dans le but d'étudier d'autres composés : le HA-1077 et le Y-32885. Ceux-ci appartiennent à une famille de molécules couramment décrites dans les recherches sur la vasodilatationvasodilatation impliquant une enzyme : la Rho-kinase. Les premiers résultats rendus publics ont rapidement été discutés car ces molécules seraient capables d'inhiber d'autres enzymes dont la protéine kinase C (Ono-Saito N. et al., 1999, Amano TT. et al. 2000).
Après avoir testé ces deux produits nous avons comparé les résultats avec ceux obtenus avec des dérivés originaux afin d'essayer de définir les parties importantes de la structure.
Dans un premier temps, nous nous sommes assurés par un test LDH que nos deux produits de référence n'étaient pas cytotoxiquescytotoxiques. Dans un second temps, nous avons vérifié par l'utilisation du modèle acellulaire qu'il n'existait pas d'interaction directe entre l'anion superoxyde produit et les molécules HA-1077 et Y-32885. Nous avons ensuite montré une action inhibitrice de ces molécules sur la formation de l'anion superoxyde chez le granulocyte neutrophile. Les CI50 que nous avons calculées sont, pour le HA-1077, de 1,88.10-4 M ± 0,21.10-4 pour une activation par le PMA et de 5,26.10-4 M ± 0,16.10-4 pour une activation par le fMLP. Le calcul des CI50 pour le Y-32885 a donné 1,48.10-4 M ± 0,14.10-4 pour une activation par le PMA et 2,68.10
Mais il est important de savoir comment le HA-1077 et le Y-32885 influent sur la décroissance de la production de l'anion superoxyde. Notre hypothèse de travail étant une inhibition de la protéine kinase C qui, rappelons le, est responsable de l'activation de la NADPH oxydase produisant l'anion superoxyde, nous avons donc réalisé l'étude de liaison et l'influence que peuvent avoir ces molécules sur la translocation de la protéine kinase C.
Le ligand que nous utilisons pour cette étude de liaison est ici aussi le phorbol-12, 13-dibutyrate. Les résultats ont montré une diminution de la reconnaissance de l'ester de phorbol pour la protéine kinase C. Les CI50 de l'étude de liaison sont de 1,317.10-6 M ± 0,057.10-6 quand le HA-1077 est utilisé et de 0,789.10-6 M ± 0,024.10-6 avec le Y-32885 et ces diminutions de liaison sont réalisées de manières concentrations dépendantes.
Toutefois, comme dans le cas du chlorure de chélérythrine, nous ne pouvons pas affirmer formellement que cette inhibition de production de l'anion superoxyde est liée à la protéine kinase C. C'est pour cette raison qu'il est indispensable d'étudier la translocation de l'enzyme en présence des deux molécules afin de renforcer l'hypothèse selon laquelle l'effet anti-oxydant observé est dû à une inhibition de la protéine kinase C.
Comme lors de la mise au point du modèle, les granulocytes neutrophiles sont activés par le PMA à 160 nM pendant 5 minutes ou par le fMLP à 1 µM pendant 10 minutes. La présence de la translocation de la protéine kinase C du cytoplasme vers la membrane plasmique est vérifiée sur des milieux de référence. Pour les tubes contenant le HA-1077 et le Y-32885, deux concentrations en produit sont utilisées : une faible de 0,01 mM et une forte de 1 mM.
Dans le cas où une faible concentration est additionnée au milieu, la protéine kinase C migre normalement vers la membrane plasmique que nous utilisions le PMA ou le fMLP pour activer les granulocytes neutrophiles. Au contraire, lorsqu'il s'agit d'une concentration de 1 mM, nous avons observé une absence totale de déplacement de l'enzyme à l'intérieur de la cellule. Ceci tendrait à prouver que les deux inhibiteurs seraient capables d'agir sur la protéine kinase C et ce qui expliquerait, en partie, par ailleurs la diminution de la flambée respiratoire.
Dans ce cas, le HA-1077 et le Y-32885 peuvent être considérés comme des inhibiteurs de la protéine kinase C. Ce résultat n'est pas surprenant si l'on tient compte d'autres molécules de la famille du HA-1077 comme le H-7 (1-(isoquinolinylsulfonyl)-2-méthylpipérazine) qui a une mauvaise sélectivité pour différentes kinases. Sa CI50 pour la PKC est de 1,8 µM, pour la protéine kinase A de 1,6 µM et pour la phosphorylase kinase de 6,5 µM (Bradshaw D. et al., 1993). Ceci peut être expliqué par le mode d'action de ces différents composés : leurs sites de fixation se situent au niveau de la protéine qui sert à la reconnaissance de l'ATPATP nécessaire à la phosphorylationphosphorylation du substratsubstrat, or ce site est hautement conservé entre les différentes kinases, entraînant une grande difficulté à obtenir des molécules sélectives pour l'une ou l'autre d'entre elles en utilisant cette partie de l'enzyme comme cible (Johnson L.N. et al., 1996).
Les deux molécules de référence s'étant montrées actives sur la protéine kinase C, nous allons pouvoir tester les produits originaux (CED-28, CED-32, CED-33 et CED-39) en espérant être capables, grâce aux différentes pharmacomodulations, de mettre en évidence les parties de la structure de ces molécules qui sont indispensables pour une reconnaissance efficace de la protéine kinase C.
Comme précédemment, la première étape est de mesurer un éventuel effet sur la production de l'anion superoxyde. Nous nous sommes assurés, au préalable, de l'absence de cytotoxicité de chacun des composés et de l'absence d'interaction entre ceux-ci et l'anion formé. Lors d'une activation des granulocytes neutrophiles par le fMLP, les quatre produits se sont montrés inhibiteur de la flambée respiratoire chez les polymorphonucléaires à des niveaux comparables. Les CI50 que nous avons pu calculer sont de 5,15.10-4 M ± 0,22.10-4 pour le CED-28, de 4,94.10-4 M ± 0,09.10-4 pour le CED-32, de 3,59.10-4 M ± 0,12.10-4 pour le CED-33 et de 6,82.10-4 M ± 0,08.10-4 pour le CED-39. Ces premiers résultats correspondent à ceux trouvés dans le cas de deux molécules de référence et sembleraint montrer qu'ils sont actifs sur la protéine kinase C. Lorsque les cellules ont été stimulées par le PMA à 160 nM pendant 5 minutes, seul le CED-28 a été capable d'inhiber la production de l'anion superoxyde avec une CI50 de 5,73.10-4 M ± 0,25.10-4, les trois autres composés n'ont eu aucun effet sur cette production. Ceci voudrait dire que le CED-32, le CED-33 et le CED-39 ne sont pas capables d'inhiber la PKC et que l'inhibition relevée lors d'une activation par le fMLP est le résultat d'une action de ces produits avec d'autres éléments cellulaires impliqués dans les voies de transductiontransduction conduisant à la formation de l'anion superoxyde. Cette deuxième inhibition peut se situer à divers niveaux, en amont de l'activation de la protéine kinase C (récepteur membranaire, protéine Gprotéine G, phospholipase ...) ou en aval, c'est à dire aux niveaux des protéines permettant la constitution et la stimulation de la NADPH oxydase. Il est peu probable que ce soit la deuxième solution car dans ce cas lors d'une activation par le PMA, les molécules interagiraient non seulement avec la protéine kinase C mais également sur la NADPH oxydase et nous aurions alors mesuré une inhibition de la production de l'anion superoxyde. Dans le cas d'une inhibition en amont de la protéine kinase C, il est peu probable que ce soit entre la protéine G et la kinase car les voies capables de stimuler l'enzyme sont multiples et il est peu vraisemblable qu'elles soient toutes bloquées en même temps. Il est donc plus raisonnable de penser que l'inhibition se situe au niveau du récepteur et mettrait en compétition le fMLP et la molécule ou alors ce serait la protéine G elle-même qui serait inhibée. Cela pourrait être vérifié en pratiquant une étude de liaison sur chacun de ces deux éléments cellulaires.
La suite de l'expérimentation consiste en l'étude de liaison avec le phorbol-12, 13-dibutyrate, ceci devrait permettre de vérifier nos premières conclusions sur le potentiel inhibiteur des composés originaux. Comme nous pouvions nous y attendre, les molécules CED-32, CED-33 et CED-39 n'ont pratiquement aucun effet sur la liaison entre l'ester de phorbol et la protéine kinase C (le CED-28 serait capable d'inhiber la PKC tandis que les trois autres seraient inactifs sur cette enzyme.
La dernière partie de l'expérimentation consiste à évaluer le potentiel qu'ont ces composés sur la translocation de la PKC du cytoplasme vers la membrane plasmique chez le granulocyte neutrophile. Comme dans les autres cas, deux concentrations sont utilisées : une faible de 0,01 mM et une élevée de 1 mM, afin de voir si la dose peut influer sur l'éventuelle inhibition. Nous avons pu vérifier que ce déplacement de l'enzyme à l'intérieur de la cellule est conservé lorsque ce sont les composés jusqu'ici jugés inactifs qui sont mis dans les milieux, c'est à dire le CED-33, le CED-32 et le CED-39. Dans le cas où c'est le CED-28 qui est testé, la translocation est inhibée que ce soit le PMA ou le fMLP qui sont utilisés comme stimulants. En ce qui concerne cette dernière molécule, cela ne fait que confirmer les conclusions déjà formulées et nous pouvons conclure que le CED-28 est un inhibiteur de la protéine kinase C. Le fait que la translocation de la protéine kinase C ne soit pas affectée par les trois autres molécules confirme dans ce cas que le CED-32, le CED-33 et le CED-39 ne sont pas des inhibiteurs de la protéine kinase C. Ces résultats nous permettent d'élargir notre analyse car nous avons pu mettre en évidence que lors d'une activation par le fMLP, nous avons une inhibition de la translocation de la protéine kinase C alors que ces composés ne sont capables d'interagir avec l'enzyme elle-même. Ce qui signifie que l'inhibition s'effectuerait en amont de la PKC.
Cette conclusion permet de confirmer, en partie, que l'inhibition de la flambée respiratoire est plus probablement due à une action sur le récepteur membranaire ou sur la protéine G et non pas à une action sur la NADPH oxydase. Car si c'était la deuxième solution, la translocation de la protéine kinase C aurait eu lieu normalement.
Le principal intérêt concernant le test des molécules originales reste de définir les parties de la molécule qui interviennent dans la reconnaissance avec la protéine kinase C dans le but de l'inhiber.
Le CED-39 est inactif sur la PKC, cette absence d'activité est probablement due au fait qu'une partie du bicycle est sous une forme réduite, et donc de lui faire perdre une partie de ses électronsélectrons π et entraînant une modification de ses propriétés sur le plan de l'électronégativité, impliquant la formation d'une molécule ne posssédant pas une capacité suffisante pour inhiber les différentes isoformes de la protéine kinase C.
Les autres composés sont issus de la même famille de pharmacomodulations. Pour arriver au CED-28, un groupement apolaire a été enlevé à partir d'une molécule, non testée dans notre modèle, ayant servi de base de travail en ChimieChimie.
Cette première modulationmodulation ne semble pas avoir eu d'influence sur l'activité inhibitrice de la molécule. Ceci n'est pas surprenant car le caractère apolaire du groupement suprimé paraît négligeable si on le compare au caractère polaire du groupement aminé et à l'influence des électrons π du cycle aromatiquearomatique qui se situent de part et d'autre de ce groupement apolaire. Dans la structure du CED-32, le cycle aromatique a été substitué par un cycle non aromatique de même encombrement stérique et le cycle aromatique possédant un atomeatome d'azoteazote par un cycle aromatique ne possédant pas d'azote mais dont l'enconbrement est similaire.
Ces modifications entraînent une inactivité de la structure vis à vis de la protéine kinase C. Nous pouvons conclure que le fait de remplacer les électrons π par une fonction apolaire conduit à la perte du potentiel de la molécule à inhiber la PKC. L'atome d'azote contenu dans le cycle aromatique est primordial pour avoir une molécule active. En remettant le cycle aromatique à la place du cycle non aromatique dans le CED-33, nous n'avons pas noté de caractère inhibiteur pour cette structure envers les différentes isoformes de la protéine kinase C présentes dans notre modèle.