au sommaire
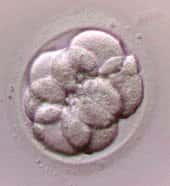
C'est alors qu'a émergé durant l'année 1998 une technique dérivée de la maîtrise, acquise depuis plus de 15 ans, de la culture de cellules souches embryonnairescellules souches embryonnaires (cellules ES) chez la souris. A partir de blastocystesblastocystes humains ou de gonadesgonades primitives, des cellules humaines multipotentes ont pu être mises en culture (1,2). Il existe à ce jour au moins de soixantaine de lignées de cellules ES humaines établies dans le monde(3), et de nombreuses autres devraient être progressivement dérivées dans les pays autorisant cette pratique ou s'apprêtant à l'autoriser, par exemple la France.
De telles lignées cellulaires pourraient naturellement régler le problème de la faible disponibilité du tissu fœtal. Cependant, le problème de l'incompatibilité immunologique persistera et, de plus, on est encore fort loin, chez la souris comme, à fortiori, chez l'homme de savoir maîtriser à volonté la différenciation de ces cellules souches embryonnaires vers le type de cellules différenciées que l'on désirerait greffer. De nombreuses vérifications sont de plus indispensables afin de s'assurer de l'absence de tumorigénicité de ces cellules. Ces études fondamentales sur les propriétés des cellules souches embryonnaires humaines sont compliquées par les difficultés de culture propres à ce matériel, qui semblent bien supérieures à celles rencontrées dans le maniement des cellules ES murines(4). C'est dire que des études préliminaires considérables restent nécessaires avant que de pouvoir confirmer les espoirs investis en ces cellules, et mettre sur pied les premiers essais cliniquesessais cliniques.
Corps humain vu aux rayons X. © PublicDomainPictures - Domaine public
La question de l'incompatibilité immunologique pourrait naturellement être réglée si les cellules souches embryonnaires étaient dérivées d'embryonsembryons clonés par transfert du noyau d'une cellule de la personne à traiter dans un ovocyteovocyte receveur énuclé(5). Compte tenu des obstacles techniques et des questions éthiques qui persistent quant à la création par clonageclonage d'embryons humains à des fins de thérapie cellulairethérapie cellulaire, abordées plus loin, on pourrait également envisager de « personnaliser » des cellules ES humaines en lignée grâce à l'échange de leur noyau contre celui d'une cellule du malade que l'on désire soigner. Il est aussi concevable de constituer des banques de cellules souches embryonnaires humaines préparées à partir des dizaines de milliers d'embryons surnuméraires, congelés après fécondation in vitrofécondation in vitro, non utilisés à des fins procréatives et voués à la destruction. Ces différentes colonies seraient soigneusement caractérisées pour les antigènesantigènes du complexe majeur d'histocompatibilitécomplexe majeur d'histocompatibilité, comme cela existe déjà aujourd'hui pour les collections de cellules souches hématopoïetiques de sang de cordon. La tolérance immunologique à ces cellules pourrait, de plus, être améliorée par manipulation génétiquegénétique. Le but serait ici de modifier l'expression des molécules du complexe majeur d'histocompatibilité, ou celles de facteurs membranaires associés intervenant dans l'activation de la réponse immune et dans la mort cellulaire.
- Médecine régénératrice et cellules souches des tissus différenciés
Il apparaît aujourd'hui de plus en plus évident depuis environ trois ans qu'il pourrait n'être pas indispensable de partir de cellules embryonnaires puisque des cellules au fort potentiel régénératif semblent persister dans de nombreux tissus, y compris chez l'adulte. De plus, ces cellules souches, initialement considérées comme irréversiblement engagées dans une voie de différenciation donnée, sont en réalité d'une plasticité beaucoup plus importante qu'on ne l'imaginait. Les articles se multiplient aujourd'hui pour démontrer qu'existent dans la zone sous-ventriculaire du système nerveux centralsystème nerveux central des cellules souches neurales qui, chez l'adulte, entretiennent une neurogenèse continue (6,7). Dans certaines expériences, ces cellules souches neurales se sont révélées capables de se différencier en cellules de divers types(8). Une population à 80% homogène de cellules souches neurales a pu être isolée de souris adultes, par fractionnements cellulaires à partir de la paroi des ventriculesventricules latéraux. Un tiers de ces cellules semble résider dans la couche épendymaire, les deux tiers restant dans la région sous-épendymaire. La multipotence de cette population est illustrée par sa possible différenciation, in vivoin vivo, en neuronesneurones et cellules glialescellules gliales et, ex vivoex vivo, également en myotubes(9). Des cellules souches neurales ont aussi été isolées, à un moindre degré de purification, de cerveaux humains, y compris adultes. Comme on pouvait intuitivement s'y attendre, l'abondance en ce type de cellules diminue considérablement avec l'âge (10).
Les cellules souches hématopoïétiques peuvent engendrer non seulement les différents lignages sanguins, mais aussi du muscle(11), du foiefoie(12) et d'autres tissus endodermiques, et même des cellules nerveuses, selon certaines études (13,14). Il est, symétriquement, possible d'isoler à partir du muscle des cellules ayant la capacité de repeupler la moelle osseusemoelle osseuse(15). Des angioblastes ressemblant aux hémangioblastes embryonnaires ont aussi été caractérisés dans la moelle humaine(16). Ils peuvent se différencier en cellules endothéliales et permettre d'engendrer une néovascularisationnéovascularisation. Enfin, la moelle contient également des cellules souches mésenchymateuses qui peuvent donner du cartilagecartilage, de l'os, des tendons, du tissu adipeuxtissu adipeux, du muscle et des cardiomyocytescardiomyocytes (17,18). De spectaculaires résultats ont ainsi été publiés par greffegreffe de différentes populations de cellules médullairesmédullaires dans des cœurs de rats lésés par cryolésion(19) ou ischémieischémie(16,20) expérimentales. La peau et le dermederme constituent à l'évidence un tissu d'accès facile, et dont l'utilisation pour la reconstitution ex-vivo de peau greffée chez les brûlés est déjà ancienne. C'est dire le considérable intérêt de la publication démontrant le potentiel prolifératif et la multipotentialité de cellules souches dermiques de souris (20). Des « skin-derived precursors », cellules souches murines peuvent se différencier en neurones, cellules gliales, cellules musculairescellules musculaires lisses et adipocytesadipocytes. Des précurseurs prélevés sur des scalpsscalps humaines auraient eux aussi le pouvoir de se différencier en neurones. Il est probable que dans les années qui viennent, d'autres sources de cellules progénitrices dotées d'une certaine plasticité de différenciation seront dévoilées. Ainsi, la solution de la thérapie cellulaire est-elle peut être en chacun d'entre nous.
Naturellement, les performances de ces cellules souches spécifiques dans la reconstitution des tissus dont elles sont issues, à fortiori dans leur aptitude de différenciation en d'autres types de lignage, restent souvent insuffisantes, probablement parce que l'on ne sait pas encore les maîtriser. Maîtrise signifie ici l'utilisation des facteurs de croissancefacteurs de croissance, cytokinescytokines et facteurs de survie qui devraient permettre, pour chaque population cellulaire, d'assurer son expansion et d'orienter sa différenciation. Il est hautement probable que le développement rapide des programmes de génomiquegénomique fonctionnelle faisant suite au séquençageséquençage du génomegénome humain permettra d'accroître nos connaissances sur l'éventail des facteurs permettant de contrôler la régénération tissulaire à partir de populations minoritaires de cellules souches. Dans l'avenir, par conséquent, il y a fort à parier que la combinaison de ces facteurs d'expansion et de différenciation, soit directement in vivo, soit ex vivo, appliquée à des cellules en culture, permettra d'augmenter considérablement les possibilités de cette véritable médecine régénératrice. Dans certains cas, l'efficacité d'une repopulation cellulaire exigera d'ajouter aux cellules ainsi stimulées des transgènestransgènes leur assurant un avantage sélectif. Les réelles perspectives de ces approches ont bien été démontrées en ce qui concerne la régénération des tissus sanguins (22,23) et du foie (24,25). Evidemment, cette approche pourra être couplée à différents types de transfert de gènesgènes dans des cellules en culture, qu'il s'agisse d'améliorer les caractéristiques des cellules en régénération ou de leur conférer un rôle thérapeutique qu'elles n'ont pas physiologiquement(23,25).