au sommaire
Lymphocyte T et reconnaissance de l'antigène
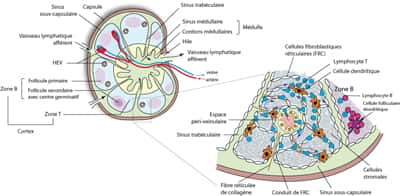
La reconnaissance du peptide antigénique par le LT s'effectue grâce à un récepteur de surface dédié, le récepteur TT (ou TCR). Cette molécule (il s'agit en fait d'une association entre plusieurs molécules distinctes, le TCR proprement dit et le complexe multimoléculaire CD3, dont on peut avoir un aperçu et une description succincte dans la figure 10) a la particularité comme nous l'avons vu d'être pour chaque cloneclone T une clef unique qui va lui permettre de reconnaître l'antigèneantigène à la surface de la DC. Imaginons notre LT scannant fébrilement l'environnement ganglionnaire : soudain son récepteur T identifie ce qui constitue pour lui l'unique but de sa quête, le peptide antigénique. Son comportement en est alors radicalement bouleversé, en quelques minutes. Plus besoin de courir en effet, il vient de trouver sa raison d'être. Le LT « virevoltant » décrit plus haut va alors devenir un « amant » fidèle de celle qui vient de lui offrir le « cadeau antigénique ». Les deux cellules vont alors former un contact stable qui va durer plusieurs heures.
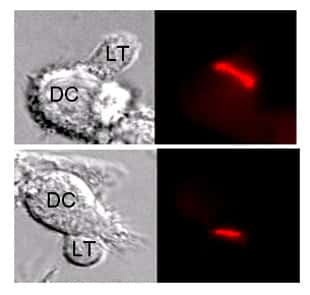
Film 3. On peut voir dans ce petit film un lymphocytelymphocyte T qui vient de reconnaître l'antigène à la surface d'une cellule dendritique. Un contact étroit entre les deux cellules se met très vite en place, contact qui va se prolonger plusieurs heures. La couleur bleue du lymphocyte T, passant au rouge, est liée à la présence dans la cellule d'un indicateur fluorescent qui permet de mesurer les variations du calcium intracellulaire. La couleur bleue correspond à des niveaux faibles de calcium, la couleur rouge indiquant au contraire des niveaux élevés. Cette augmentation du calcium est un des premiers évènements d'activation que l'on peut observer dans le lymphocyte T quelques secondes après la reconnaissance de l'antigène.
Un exemple typique montrant la formation de ce conjugué entre un LT naïf et une DC est montré dans le film 3. Le LT, plus petit, y est facilement identifiable car il a été chargé avec un composé fluorescent permettant de mesurer les niveaux de calcium dans la cellule.
- Figure : 6 - Cliquer sur l'image pour l'agrandir
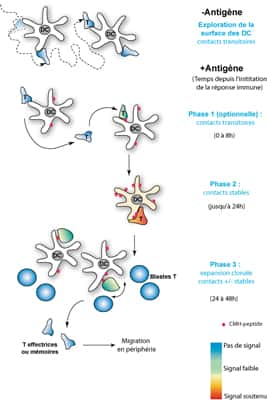
Légende : Plusieurs phases ont été rapportées pour décrire le comportement d'un LT au sein des ganglions lymphatiquesganglions lymphatiques quand il rencontre une DC présentant l'antigène. La phase 1 pendant laquelle le LT établit des contacts transitoires de quelques heures avec différentes DC n'a pas toujours été observée par les expérimentateurs. En résulterait un signal d'activation faible dans le LT (voir le code couleur indiqué en bas à droite). La phase 2 en revanche correspond à une phase de contact stable, très prolongée (jusqu'à 24h), qui permettra au LT d'atteindre le niveau d'activation optimale requis pour se mettre à augmenter de taille et à se diviser très activement (phase 3). Des populations de LT effecteurs et de LT mémoires, de même spécificité antigénique, en résulteront. Elles quitteront ensuite le ganglion pour migrer dans les tissus périphériques.
Ceci a également été observé in vivoin vivo dans les ganglions où différentes phases ont cependant été décrites suggérant que la reconnaissance n'entraînerait pas ipso facto un arrêt instantané du LT sur la DC (figure 6). Une phase initiale de contacts transitoires où le LT continuerait de passer d'une DC à l'autre a ainsi été observée dans certaines études, mais ceci, éventuellement lié à la nature de l'antigène, à sa quantité ainsi qu'à l'affinité du récepteur T, est très controversé
La zone d'apposition étroite entre les deux cellules forme ce que l'on appelle la synapsesynapse immunologique par référence à sa cousine connue de bien plus longue date, la synapse neuronale. Rappelons ici que le mot synapse est dérivé du grec sunapsis signifiant union, ce qui donne à ce vocable, si on s'arrête à cette définition stricte, une dimension assez floue en vérité. Il est en effet d'innombrables situations de contact cellule-cellule en physiologie, en dehors des systèmes nerveux et immunitaires, sans que l'on parle de synapse. Disons que les immunologistes ont une certaine propension à « coller aux basques » de leurs collègues neurobiologistes ! Il est vrai que des similitudes existent entre les deux systèmes qui pourraient le justifier, mais c'est un autre débat.
Quoiqu'il en soit le concept de synapse immunologique est aujourd'hui incontournable. Depuis une quinzaine d'années, un nombre considérable de travaux lui ont été dévolus. Ils sont difficiles à résumer en quelques lignes et nous y avons récemment consacré un article en français dans la revue Médecine Sciences auquel on pourra se référer. Disons brièvement qu'une des raisons d'être de ce phénomène est de mettre en place entre les deux cellules un véritable échaffaudage moléculaire autour du récepteur T après que celui-ci ait reconnu l'antigène.
Pour employer une image, le TCR est le premier boulon posé sur cet échafaudageéchafaudage, dans lequel d'autres types de récepteurs (comme les molécules d'adhésion LFA-1 et de co-stimulationstimulation CD28 et leurs co-récepteurs sur les DC) vont à leur tour interagir.
Ceci aura pour effet d'une part de stabiliser l'interaction, et d'autre part d'activer dans le LT une série de programmes moléculaires spécifiques, nous y reviendrons. En tout état de cause, ce qui est assez remarquable, c'est qu'il a été montré que la reconnaissance de quelques récepteurs T suffit à déclencher le processus, témoignant d'une sensibilité extrême du système. Etre très vite réactif, dès les premiers stades de l'agression, alors que la quantité d'antigènes étrangers est encore minime, est en effet un impératif.
- Figure : 7
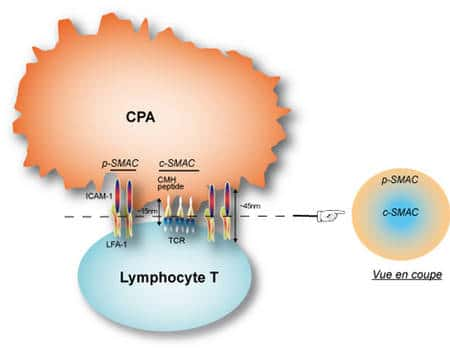
Légende : Lorsqu'une interaction stable est formée entre un lymphocyte T et un substitut de cellules présentant l'antigène (cellule B, bi-couche lipidique dans laquelle des complexes CMHCMH-peptide et des molécules ICAM-1 ont été insérées) on observe que la synapse immunologique à la membrane de la cellule T présente une zone centrale enrichie en TCR, le c-SMAC pour « central-Supra Molecular Activation Cluster » et une zone périphérique riche en molécules d'adhésion LFA-1, le p-SMAC (p pour « peripheral »). Différentes hypothèses ont été avancées pour expliquer cette organisation, comme la taille des domaines extracellulaires des différents couples ligandligand-récepteur, ce qui conditionnerait « passivement » la taille de la fente synaptiquefente synaptique, ~15nm au niveau du c-SMAC, et ~45nm au niveau du p-SMAC. Sur une analyse en coupe on obtient ainsi une structure en cocarde (dite en « bull eye » par nos collègues anglo-saxons).
Une des grandes controverses sur la synapse immunologique fut de savoir si au plan moléculaire elle était hautement organisée, sur la foi en particulier de travaux utilisant des synapses artificielles ou des cellules présentatrices différentes des DC. Comme cela est indiqué dans la légende de la figure 7, ces travaux montraient que la synapse immunologique était fortement structurée et organisée, en fonction notamment de la position centrale ou périphérique des différents type de récepteurs.
- Figure : 8
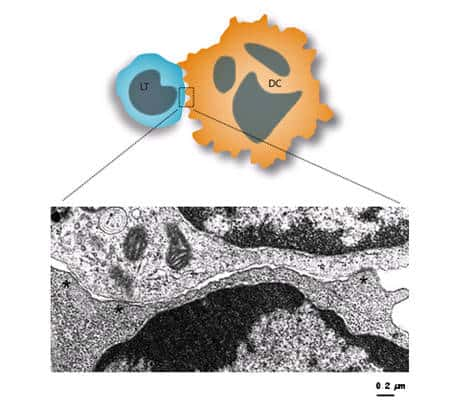
Légende : Image en microscopie électronique montrant que la synapse T-DC est multifocale. Des zones d'apposition très serrées sont visibles (astérisques) ainsi que des zones d'apposition beaucoup plus lâches, montrant le caractère peu organisé dans son ensemble de la zone d'interaction, pourtant très étendue, formée par les deux cellules. L'hypothèse est que chacune de ces zones très serrées agissent comme une unité de signalisation indépendante (une « mini synapse » en quelque sorte), dont la duréedurée de vie pourrait être transitoire, et remplacée par d'autres pendant toute la durée du contact. On aurait ainsi un système extrêmement fluctuant et dynamique, multifocal, très éloigné du modèle de synapse concentrique. © Cliché G. Raposo, Institut Curie, Paris
Nos travaux ont largement contribué à montrer que cette vision était fausse quand on utilise des DC, montrant une structure beaucoup plus fluctuante et dynamique dans laquelle le LT et la DC présentent des points d'ancrage multiples (voir la figure 8) pour maintenir un contact étroit, les deux cellules modifiant en permanence ces « mini synapses » durant leur interaction.
Quoiqu'il en soit, l'efficacité de cette interaction et sa durée sont des paramètres essentiels qui vont conditionner l'activation ultérieure du LT. Il est en effet acquis que les signaux d'activation déclenchés en aval du TCR dans le LT sont maintenus dans le temps, plusieurs heures. Ceci n'a pas encore pu être démontré in vivo, mais est en revanche manifeste in vitroin vitro. La synapse contribue très vraisemblablement à ce phénomène en favorisant un engagement accru de molécules de costimulation et le réamorçage de la reconnaissance de l'antigène via des phénomènes de recyclagerecyclage du TCR. La synapse pourrait aussi favoriser la libération locale de médiateurs solubles, permettant une stimulation réciproque des deux partenaires cellulaires. La fonction première de la synapse entre LT et DC serait donc de permettre au LT d'atteindre un seuil d'activation critique pour sortir de son état initial, dit de repos.