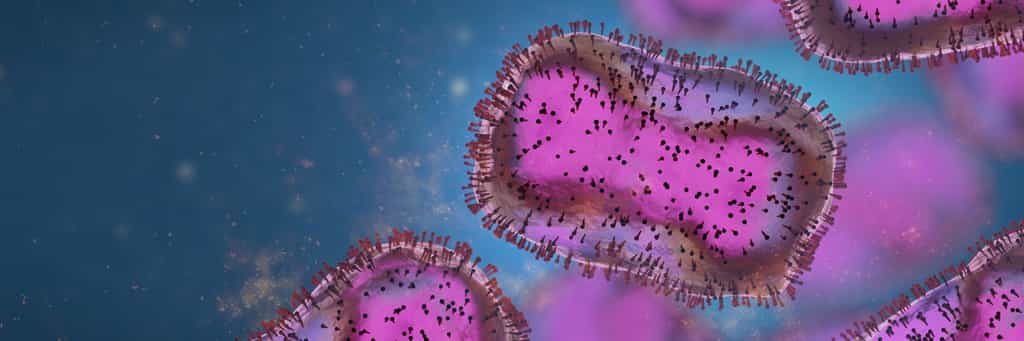
D'où vient la souche de variole du singe qui se transmet actuellement hors d'Afrique ? Une question complexe que les scientifiques essayent de décrypter, en faisant des analyses génétiques. La dernière en date livre des premiers éléments de réponse.
au sommaire
Les premiers résultats de l'analyse génétique de la souche de la variole du singe prélevée au Portugal ont révélé que la souche qui a contaminé 780 personnes hors d'Afrique était, au moment où ces lignes sont rédigées, reliée phylogénétiquement à celle de 2017-2019, isolée à Singapour, Israël au Nigeria et au Royaume-Uni.
Aujourd'hui, deux spécialistes de l'évolution des virus de l'université d'Edinburgh en Écosse ont fourni une analyse génétique beaucoup plus détaillée et qui fournit des clés pour comprendre pourquoi cette souche du virus de la variole du singe se diffuse aussi bien entre les humains.
47 mutations dans la souche de la variole du singe de 2022
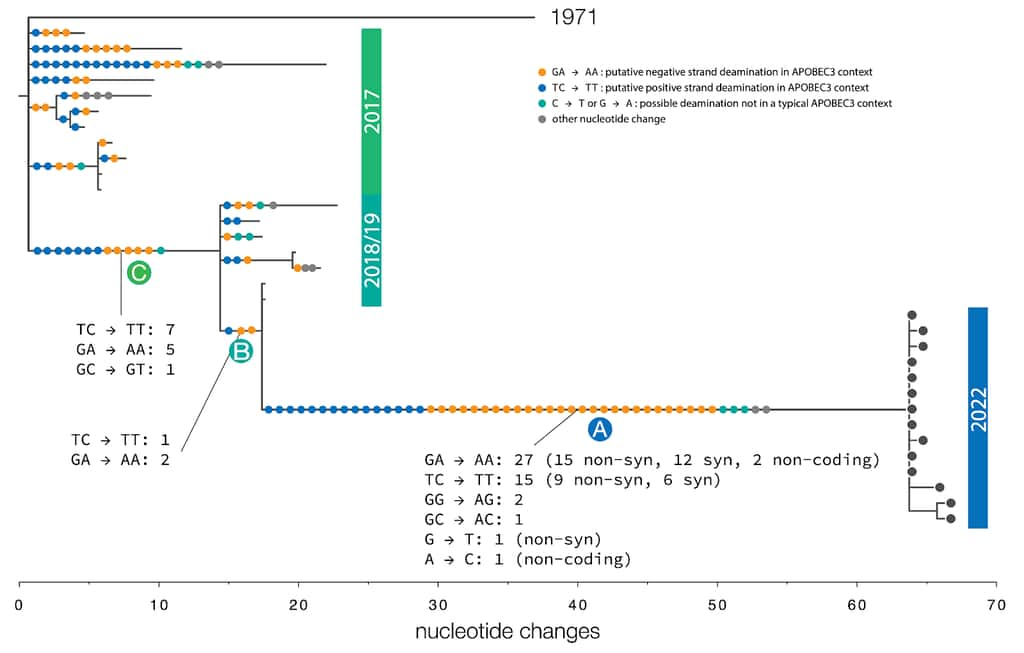
Entre la souche de 2022 et ses ancêtres les plus récents de 2017-2019, il y a 47 nucléotides de différence. C'est-à-dire qu'en l'espace de quelques années, le virus a accumulé 47 mutations. C'est beaucoup quand on sait que le taux de mutation de la variole, un autre orthopoxvirus, est d'une ou deux mutations par an.
Savez-vous vraiment comment se transmet la variole du singe et qui est susceptible de l'attraper ? Julie Kern fait le point dans cet épisode de la Santé sur Écoute. © Futura
Ce nombre inhabituel de mutations pourrait être le signe d'une adaptation du virus de la variole du singe à l'être humain. Une hypothèse en cours d'étude en ce moment même et qui ne donne pas encore de réponse claire. En effet, la majorité des mutations observées sont dues à l'action d'une enzymeenzyme antivirale, Apobec3, qui agit contre les virus en introduisant des mutations dans leur ADNADN dans l'espoir de les rendre non-viables et de bloquer leur réplicationréplication.
Apobec3 provoque des désaminations, elle cible principalement les duos de bases TC, les transformant en TT (ou leur équivalent AGAG vers AA), et GG, les convertissant en AG (ou leur équivalent AA vers AC). Parmi les 47 mutations identifiées, 42 sont des désaminations TC vers TT et 3 de GG vers AG. Les deux restantes sont le résultat d'autres mécanismes.
L'enzyme Apobec3 est donc la principale source de mutations dans le génomegénome du virus de la variole du singe. Cette observation soulève plusieurs questions. A-t-elle agi dans des réservoirs non-humains avant d'émerger chez l'être humain ? Le système anti-viral Apobec existe chez les rongeursrongeurs mais il ne laisse pas les mêmes signatures dans le génome des virus sur lequel il agit.
Une circulation interhumaine de longue date ?
Ces mutations sont-elles le témoin d'une adaptation sur plusieurs années du virus à l'être humain ? Sur ce point, les scientifiques suggèrent que « le schéma que nous voyons dans ces génomes MPXV (monkeypoxvirus) depuis 2017 indique une réplication chez l'Homme et que l'héritage des changements spécifiques survenus entre 2017 et 2018, puis dans les virus à partir de 2022, signifie qu'il y a eu une transmission interhumaine soutenue depuis au moins 2017 ».
En 2017, des cas de variole du singe, animaux et humains, ont été rapportés dans plusieurs pays d'Afrique centrale et de l'Ouest, notamment plusieurs milliers par an en République démocratique du Congo. Il s'agissait, la plupart du temps, des transmissions animal-homme. S'il y a eu une transmission interhumaine soutenue, comme le pensent les scientifiques, avant la situation actuelle, elle est passée inaperçue. Des résultats supplémentaires sont attendus pour comprendre pourquoi il y a autant de cas de variole du singe hors d'Afrique.