Une récente étude parue dans la revue Nature suggère que plusieurs médicaments déjà sur le marché pourraient s'avérer utiles contre le SARS-CoV-2. Dans le lot, un anticancéreux et un immunosuppresseur.
au sommaire
Depuis l'apparition du SARS-CoV-2 en décembre 2019, le monde de la recherche s'attelle à réaliser des expériences pour trouver une thérapeutique adéquate. Des essais cliniques ont été menés à travers le monde. On sait maintenant réduire la mortalité de la maladie chez les patients graves. Mais on ne sait toujours pas prévenir ces formes sévères qui ne sont pas sans conséquences. D'autres expériences ont été menées pour trouver des médicaments appropriés mais cela n'a rien donné (oui, même pour l'hydroxchloroquine). Étant donné que le développement de nouveaux médicaments prend du temps et coûte cher, mieux vaut se rabattre sur des moléculesmolécules qui existent déjà et qui pourraient cibler l'immensité des interactions possibles entre le SARS-CoV-2 et l'organisme lors de l'entrée du virus dans ce dernier. C'est ce qu'ont fait des chercheurs américains et chinois qui publient leurs résultats dans la revue Nature.
Les organoïdes à la rescousse
Qu'est-ce donc qu'un organoïde ? Littéralement, cela signifie « qui ressemble à un organe ». Pour avoir plus de détails, nous avons posé quelques questions à Eric Billy, chercheur dans les domaines de la génétique et du cancer, chef de laboratoire à l'Institut de la Recherche biomédicale chez Novartis. Il nous précise qu'il existe deux types d'organoïdes distincts.
« Vous avez les organoïdes issus de biopsiesbiopsies humaines. Dès le départ, ils sont pluricellulaires. On les met en culture dans des conditions particulières pour espérer recréer des conditions proches de l'état du patient à qui l'on a fait subir la biopsie (une croissance tridimensionnelle, développement des interactions de plusieurs types cellulaires et des conditions tissulaires similaires). L'avantage de ces organoïdes, c'est qu'ils sont issus de tissus humains dont l'hétérogénéité cellulaire est extrêmement difficile à recréer artificiellement. Le bémol, c'est que l'on peut avoir une grande variabilité d'une biopsie à l'autre », explique Éric Billy.
Il continue sur le second type d'organoïde : « À l'inverse, vous avez les organoïdes obtenus de manière artificielle, synthétique. On prend des cellules souchescellules souches et on les programme pour recréer des structures tridimensionnelles caractéristiques des organes et des types cellulaires que l'on souhaite étudier. Le point fort de cette méthode, c'est que l'on contrôle tout le processus de A à Z. L'inconvénient, c'est que la complexité de l'organoïde est limitée », développe-t-il. Dans le monde de la recherche, on fait aussi croître des organoïdes dans des organismes vivants, généralement des rongeursrongeurs, pour encore mieux étudier la réponse à certaines thérapeutiques.
« Dans la recherche contre le cancer, on fait aussi des essais sur des biopsies humaines que l'on a fait croître in vivoin vivo sur des souris afin de mesurer leur capacité de réponse à des traitements anticancéreuxanticancéreux. Une expérience a même été surnommée en interne le mouse clinical trial. Dans ces expériences, les chercheurs ont testé l'ensemble des traitements standard chez des souris au sein desquelles on avait fait se développer des blocs de tumeurstumeurs humaines à partir d'échantillons de patients pour chaque type de cancer présent », ajoute le chercheur. Pour en savoir plus au sujet des organoïdes, notamment sur leurs enjeux éthiques, un récent rapport de l'Institut national de la Science et de la Recherche médicale (Inserm) a récemment été publié à leur sujet.
Un anticancéreux et un immunosuppresseur prometteurs
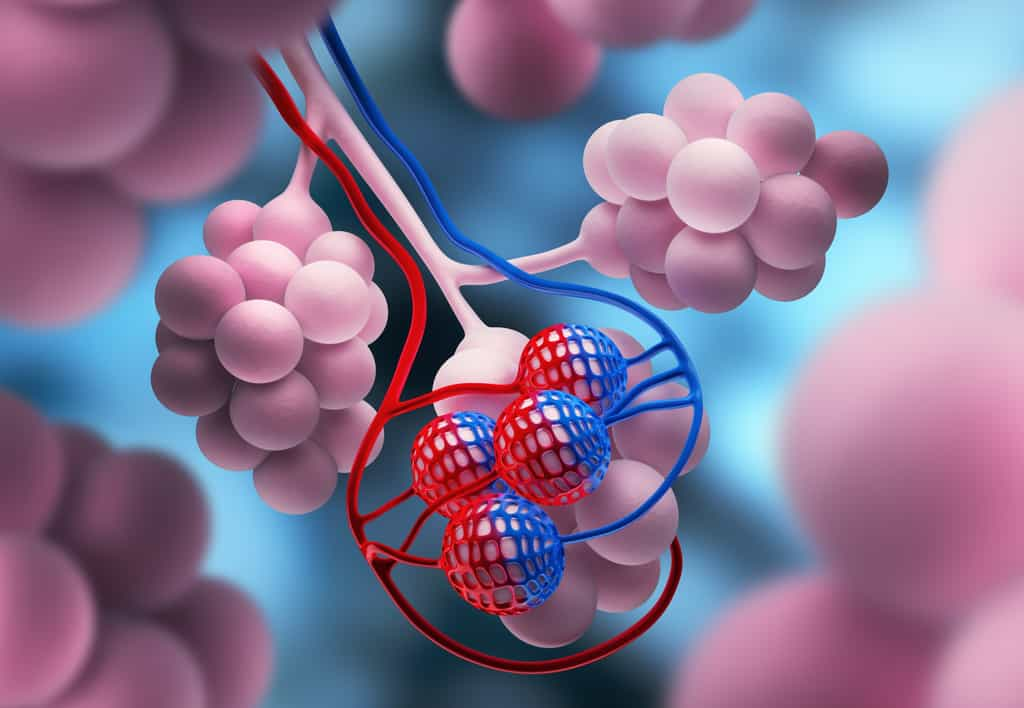
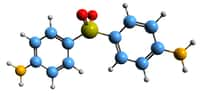
Dans l'expérience susmentionnée, les scientifiques ont utilisé les deux dernières méthodes décrites à savoir, la croissance artificielle et la croissance in vivo. Après avoir développé et validé la pertinence de leur modèle d'organe pulmonaire (expression des cellules et des enzymes clésenzymes clés dont se sert le SARS-CoV-2 pour infecter nos cellules dans le compartiment pulmonaire) et du côloncôlon, les investigateurs ont sélectionné trois médicaments après avoir criblé leurs organoïdes avec la pharmacopée approuvée par la Food and Drug AdministrationFood and Drug Administration (FDA) pour tester leur potentiel inhibiteur sur le SARS-CoV-2 : l'imatinibimatinib (anticancéreux), l'acideacide mycophénolique (immunosuppresseur) et la quinacrine dihydrochloride (antiprotozoaire). Dans un premier temps, les organoïdes ont donc été traités avec lesdites thérapeutiques, puis infectés par le SARS-CoV-2. Le matériel génétiquematériel génétique viral était considérablement plus faible dans les organoïdes traités de même que l'expression de la protéineprotéine Spike (ou protéine de pointe), caractéristique des coronavirus.
« Les auteurs de cet article utilisent dans leur expérience un pseudo-virus exprimant la luciférase, une protéine dont l'activité enzymatiqueenzymatique permet l'émissionémission de bioluminescencebioluminescence, mesurable et quantifiable. L'intérêt de cette technique (pseudo virus avec gènegène rapporteur bioluminescent), c'est que l'on peut visualiser l'infection des cellules par le virus et la capacité du génome viral à être exprimé (évalué ici par l'activité de la luciférase) », détaille Éric Billy.
Dans un second temps, nos expérimentateurs ont voulu évaluer les médicaments in vivo. Ils ont donc traité des souris humaniséessouris humanisées portant des xénogreffesxénogreffes (terme désignant la transplantationtransplantation d'un greffongreffon où le donneur est d'une espèceespèce différente du receveur) d'organoïdes pulmonaires. De façon similaire à ce qui avait été observé dans les seuls organoïdes, l'activité de la luciférase a été significativement diminuée avec les traitements.
« L'expérience in vivo repose sur l'injection dans la xenogreffe du pseudo-virus après avoir prétraité ou non les animaux avec l'une des 3 molécules candidates. Ces dernières ont démontré dans cette évaluation in vivo leur capacité à bloquer l'infection virale de manière prophylactique (molécule donnée avant l'exposition au virus). C'est un modèle in vivo mécanistique, déclare le scientifique. L'expérience in vivo suivante est le traitement pré- ou post-infection dans un modèle animal pertinent pour les coronaviruscoronavirus (le furet) via une infection virale par les voies aériennes. On espère voir rapidement cette expérience réalisée car ces trois molécules sont connues et leurs données pharmacocinétiques et dynamiques disponibles ».
Des essais cliniques en cours
Quatre essais cliniques sont actuellement enregistrés pour tester l'imantinib chez des patients atteints de la Covid-19Covid-19. Mais, pour Eric Billy, ces molécules n'auront d'intérêt (si elles en ont un) que si elles sont données rapidement chez les personnes ayant le plus de risques d'avoir une réponse immunitaireréponse immunitaire incomplète ou présentant des comorbiditéscomorbidités.
« Il y a un point important que l'on occulte encore en partie aujourd'hui dans certains discours par rapport à l'aspect clinique. La forme sévère de la Covid-19 est la conséquence de la destruction tissulaire des endothélium et épithéliumépithélium par le virus. Cette destruction est la conséquence d'une réponse immunitaire incomplète pour des raisons multifactorielles, conduisant à une lymphopénie (taux de lymphocyteslymphocytes trop bas). Dès lors, les médicaments qui ne bloquent pas l'entrée ou la multiplication du virus, ou qui diminuent la réponse immunitaire, comme l'hydroxychloroquinehydroxychloroquine ou le tocilizumab (immunomodulateurimmunomodulateur), ne peuvent, avec les connaissances que nous possédons, améliorer les formes sévères présentant des destructions tissulaires profondes conduisant à des défaillances d'organes », conclut Éric Billy.