au sommaire
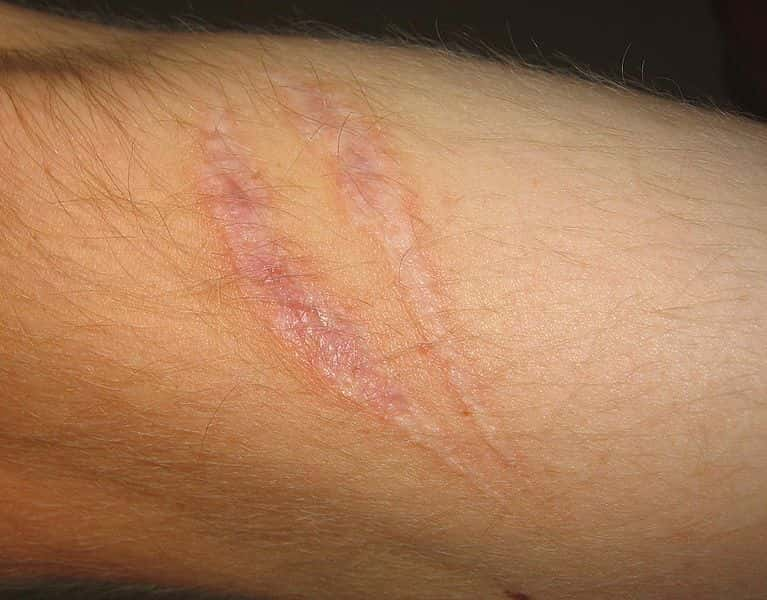
Les cicatrices sont les traces de la réparation d'une blessure par les cellules spécialisées, les fibroblastes. © Svdmolen - Creative Commons (by-nc-sa 3.0)
Après une blessure, le corps réagit pour refermer au plus vite le tissu abîmé afin d'une part d'éviter de laisser une ouverture aux bactéries qui pourraient infecter l'organisme et d'autre part de reconstituer la fonction du tissu de départ. Malheureusement, le tissu de remplacement, appelé tissu cicatriciel, est de moins bonne qualité que le tissu d'origine. Pour la peau par exemple, les cicatrices ont tendance à être plus sensibles au soleilsoleil et sont glabresglabres.
Plus grave, la reconstitution de certains organes, après une opération par exemple, peut se dérouler de manière excessive et mener à une accumulation de tissu cicatriciel, appelée fibrose. Dans ce cas, les organes concernés se retrouvent endommagés : le cœur peut perdre de sa puissance et le foie peut évoluer vers une cirrhose.
Le mécanisme de la reconstruction des tissus endommagés est connu. Des cellules spécialisées, les fibroblastes, sont attirées vers la zone blessée, et produisent de la « matrice extracellulairematrice extracellulaire » en grande quantité, composée entre autres de collagènecollagène. Une trop forte synthèse de collagène, et c'est la fibrose. Réduire la production de tissu cicatriciel serait alors la solution pour les patients.
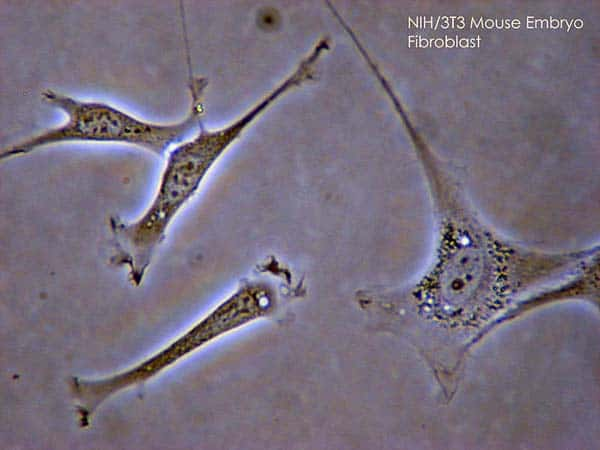
Les fibroblastes sont attirées au niveau des blessures pour former du tissu cicatriciel. © SubtleGuest / Licence Creative Commons (by-nc-sa 3.0)
Les fibroblastes en « pause »
Des chercheurs de l'Université de l'Illinois à Chicago ont réussi à réduire l'activité des fibroblastes. Cette découverte publiée dans le journal Nature Cell Biology est doublement intéressante : d'un point de vue appliqué bien sûr, mais aussi d'un point de vue fondamental.
Les biologistes cellulaires ont en effet été surpris de voir les fibroblastes entrer dans un état de sénescencesénescence, c'est-à-dire un arrêt de leur cycle cellulaire et une impossibilité de se diviser. Cet état de « pause » cellulaire bien connu n'avait jusque-là été observé que dans le cas de cellules dont l'ADNADN est endommagé, empêchant ainsi la prolifération de ces cellules potentiellement cancéreuses.
Le gènegène CCN1 est la clé du mécanisme mis en évidence dans ces travaux. Les chercheurs ont en effet démontré que la protéineprotéine CCN1 est capable de provoquer artificiellement l'activation de la voie de réponse aux dommages à l'ADN. De plus, des souris possédant une forme mutée du gène forment des fibroses exacerbées, alors que l'applicationapplication locale de la protéine CCN1 fonctionnelle sur la blessure rétablit un développement normal des tissus cicatriciels.
Cette découverte est donc prometteuse puisque des traitements pourront alors exploiter ce filonfilon pour réduire les risques de fibrose. Car non seulement les fibroblastes sénescents stoppent leur production de collagène mais en plus ils fabriquent des protéines qui détruisent la matrice extracellulaire : une double attaque contre la fibrose !