Voilà de nombreuses années que les scientifiques cherchent à mettre au point un vaccin contre le Sida et pour le moment personne n'a encore trouvé la recette miracle. Alors, pour l'heure, ils cherchent à améliorer l'efficacité de ce qui a partiellement fonctionné. D'autres pistes sont malgré tout explorées. © James Gathany, CDC, DP
- Un dossier pour tout savoir sur la vaccination contre le Sida

L'histoire se poursuit. Elle a commencé en 2009 lors d'une vaccination contre le VIH entreprise en Thaïlande auprès de plus de 16.000 personnes. L'opération fut un succès relatif, car si le traitement n'avait protégé que 31 % des patients, il s'agissait de la première thérapie contre le Sida qui montrait des résultats aussi prometteurs.
Pourquoi une efficacité seulement partielle ? Les scientifiques continuent l'enquête pour répondre à cette intrigante question. Des premiers éléments rapportés il y a quelques mois révélaient que les patients immunisés présentaient des anticorps V1V2 qui empêchaient le virus de pénétrer dans les cellules. Cette protéineprotéine cible les régions variables 1 (V1) et 2 (V2) de l'enveloppe du VIH.
Une nouvelle étude parue dans Nature démontre que la solution réside très probablement à ce niveau-là. Elle soutient en effet que le vaccinvaccin doit surtout son efficacité à deux mutations présentes dans la région V2.
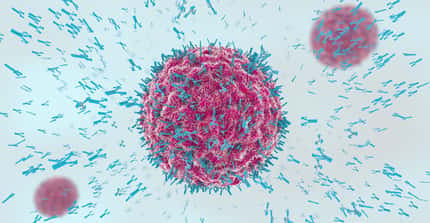
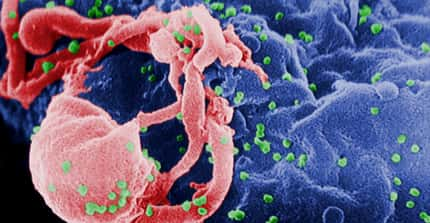
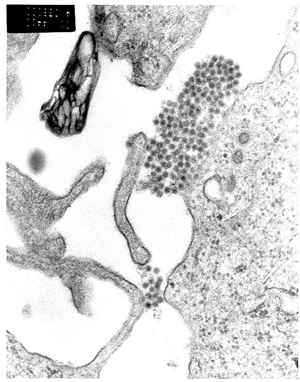
Le VIH, ici en vert, infeste et détruit les lymphocytes T4, des cellules qui régissent les défenses immunitaires. Un vaccin permet à l'organisme de se débarrasser de son hôte gênant avant qu'il ne devienne pathogène. © C. Goldsmith, CDC, DP
Deux mutations de V2 responsables du succès du vaccin
Dans cette recherche, 110 des volontaires de l'essai cliniqueessai clinique précédent ont été de nouveau recrutés. Parmi eux, 44 ont attrapé le virus malgré la vaccination, tandis que 66 autres sont tombés malades après n'avoir reçu qu'un placéboplacébo. Les chercheurs de l'US Military HIV Research Program ont alors analysé 936 séquences d'ADNADN viral chez ces sujets afin de déceler les particularités des souches de VIH ayant infecté chacun des patients.
Ils partent du postulatpostulat suivant : les personnes traitées par placébo n'ayant pas été immunisés, on retrouve chez eux tous les variants viraux. En revanche, les sujets vaccinés ont quant à eux développé une résistancerésistance contre certaines souches qu'on ne devrait pas détecter dans leur organisme, car le traitement induit une pressionpression de sélection sur les différentes formes du VIH.
Leur idée se vérifie puisque les virus ne sont pas tout à fait les mêmes dans les deux groupes, et cette différence intervient au niveau de deux sites de la région V2. Effectivement, les personnes ayant reçu le vaccin avaient 80 % de risques en moins d'être infectées par les variants du VIH présentant ces mutations. En revanche, elles n'étaient pas protégées contre les autres souches virales, expliquant pourquoi elles ont malgré tout été contaminées.
Désormais, la question qui se pose est de savoir comment améliorer le ciblage de V2 pour développer des vaccins plus efficaces encore. À n'en pas douter, les scientifiques vont tenter d'y apporter une réponse. Affaire à suivre, donc...