au sommaire
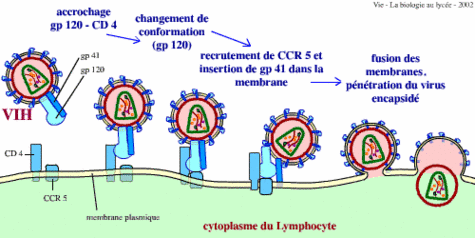
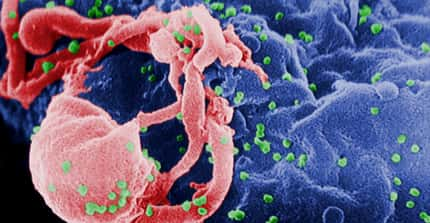
L'entrée du VIH dans les lymphocytes.Credits : "Vie - La biologie au lycée" site ressource sciences de la vie ENS-DESCO
Suite de l'actualité :
Les caractéristiques du VIH
Le Sida est une maladie dont l'origine est maintenant bien connue. Il s'agit d'un rétrovirus (virus possédant comme matériel génétiquematériel génétique un ARN et non un ADN) isolé en 1983 par le Pr. Luc MontagnierLuc Montagnier à l'Institut Pasteur.
Il existe plusieurs souches de VIHVIH (virus de l'immunodéficienceimmunodéficience humaine), la plus commune étant la souche VIH-1VIH-1.
Ce virus est constitué d'une enveloppe empruntée à la cellule lors du bourgeonnement du virus. Dans cette enveloppe sont ancrées des protéinesprotéines qui vont servir au virus à s'accrocher spécifiquement aux cellules cibles. Ensuite, on trouve une capsidecapside formée par l'assemblage d'une protéine. A l'intérieur du virus, on trouve deux brins monocaténairesmonocaténaires d'ARN (d'environ 10Kb), étroitement liés ensembles, ainsi que plusieurs enzymesenzymes virales (intégraseintégrase, protéaseprotéase, transcriptase inversetranscriptase inverse).
Les nombreuses recherches ont permis de bien comprendre le cycle de réplicationréplication du virus.
La première étape consiste en la reconnaissance par la protéine virale gp120, ancrée dans l'enveloppe du virus, d'un récepteur (nommé CD4) présent à la surface de certaines cellules immunitaires. Par l'intermédiaire de co-récepteurs (principalement des récepteurs aux chimiokines -CCR5, CXCR4-), la protéine gp41 provoque la fusionfusion des enveloppes virales et cellulaires permettant ainsi au virus d'entrer dans la cellule.
Une fois entrée, la capside se désagrège libérant l'ARN, qui va alors être transformé en ADN double brindouble brin par la transcriptase inverse (il n'est d'ailleurs pas impossible que ce cycle débute avant même l'entrée dans la cellule). Cet ADN pourra alors s'intégrer dans un chromosomechromosome à l'aide de l'intégrase apportée par le virus. Une fois intégré, l'ADN viral va exprimer à la fois un ARN messagerARN messager qui dirigera la synthèse de nouvelles protéines virales, et un ARN génomiquegénomique qui sera incorporé dans les nouvelles particules virales produites par la cellule infectée.
Une des caractéristiques du VIH est sa capacité à muter très rapidement. L'enzyme responsable de cela est la transcriptase inverse (qui assure le passage de l'ARN en ADN). Cette enzyme est une cible de choix pour les thérapiesthérapies anti-VIH car elle est spécifique du virus. Cette enzyme fait, à chaque lecture, en moyenne une erreur tous les 10.000 nucléotidesnucléotides, ce qui est extrêmement élevé, et implique que statistiquement, à chaque cycle d'infection, c'est un virus possédant une mutation qui s'intègre dans la cellule. Certaines régions ne peuvent pas subir de mutation car leur activité est essentielle au virus (les virus possédant une mutation dans celles-ci seront alors non infectieux) ; en revanche, d'autres régions dites variables acceptent sans problème majeur la plupart de ces mutations. Ainsi la protéine gp120 qui porteporte les déterminants antigéniques majeurs possède une région hautement variable. Les anticorpsanticorps fabriqués par le corps pour se défendre ont ainsi toujours un cycle de retard. C'est aussi cette grande variabilité qui rend si difficile l'obtention d'un vaccinvaccin réellement efficace.
La multiplication du virus
Une personne infectée produit entre 108 et 109 virus par jour. Dans les jours suivant la contaminationcontamination une baisse la charge viralecharge virale est observée due à la mise en place de la réponse immunitaire. Les lymphocyteslymphocytes CD8 cytotoxiquescytotoxiques sont particulièrement important durant cette phase, puisqu'ils détruisent les lymphocytes CD4 infectés avant qu'ils ne produisent de nouveaux virus.
Cependant, même si le virus peut disparaître de la circulation sanguine, il reste présent dans des réservoirs constitués des tissus lymphoïdeslymphoïdes (ganglionsganglions, raterate) où il se multiplie et peut infecter d'autres lymphocytes. Tout au long de cette phase de latencelatence, dès qu'un variant suffisamment différent pour échapper au système immunitairesystème immunitaire apparaît par mutation, celui-ci va proliférer jusqu'à ce que le système immunitaire ajuste sa réponse. Le cycle va ainsi se reproduire sans possibilité d'éradication du virus.
A chaque nouveau variant, de nombreux lymphocytes sont détruits, entraînant après plusieurs années l'épuisement du système immunitaire et la multiplication incontrôlée du virus.
Lorsque le nombre de lymphocyte CD4 est inférieur à 200 / mm3, l'organisme est alors sensible à toutes les maladies opportunistes. Ces maladies sont provoquées par des microorganismesmicroorganismes habituellement non pathogènespathogènes, mais qui tirent profit de la baisse d'immunitéimmunité pour infecter l'organisme.
Les traitements disponibles et ceux qui sont testés
Depuis la découverte du virus, les traitements permettant d'en limiter la prolifération ont fait d'énormes progrès, si bien que maintenant les malades peuvent vivre une vie quasi normale. Cependant, il n'existe à l'heure actuelle aucun traitement permettant de guérir du Sida. Les nouvelles thérapies sont efficaces, mais il y a plusieurs ombres au tableau.
Actuellement, on estime que 10% des malades sont en échec thérapeutique. Les traitements sont encore très lourds, il faut les suivre rigoureusement, et sont parfois mal supporté par l'organisme.
Voyons maintenant les différentes classes de molécules antiviralesmolécules antivirales actuellement disponibles. Ces molécules ont pour but de bloquer une étape essentielle à la multiplication du virus. Actuellement, trois de ces étapes sont prises pour cible.
Inhibiteurs de la fusion
Cette famille de molécules est la plus récente. Elles permettent d'empêcher la particule virale de fusionner avec la cellule cible et donc de pénétrer dans la cellule.
Le T20 est commercialisé depuis cette année. Cette molécule est en réalité une protéine de 36 acides aminésacides aminés qui se lie à la protéine gp41, présente sur l'enveloppe du virus, l'empêchant ainsi de jouer son rôle dans la fusion entre la membrane virale et la membrane cellulairemembrane cellulaire. Elle est spécifique du VIH-1 et est toujours associée à d'autres molécules pour limiter l'apparition de virus résistants. Une autre molécule, le T1249 est une protéine de 39 acides aminés. Similaire à un domaine de la protéine gp41, elle est actuellement en phase de test. Elle possède un plus large spectrespectre d'inhibitioninhibition (HIV-1, HIV-2, SIV). Le développement d'autres inhibiteurs est en cours, les chercheurs tentent notamment de bloquer la fonction des récepteurs CCR5 et CXCR4.
Inhibiteurs de la protéase
Le virus fabrique certaines de ses protéines sous la forme de précurseur. C'est à dire que les protéines sont fusionnées les unes aux autres et ne forment qu'une seule molécule. Il est alors nécessaire de pouvoir les séparer pour les activer. C'est le rôle d'une enzyme, la protéase, qui va découper le grand précurseur en petits fragments.
Ainsi chaque protéine ainsi obtenue va pouvoir jouer son rôle dans la multiplication du virus.
Les inhibiteurs de la protéaseinhibiteurs de la protéase ont donc pour rôle de bloquer cette étape. Certaines protéines du virus ne sont alors pas activées et restent donc non fonctionnelles. De nombreuses résistancesrésistances sont apparues au cours des années. Les recherches actuelles se focalisent sur l'identification de nouveaux inhibiteurs capables d'agir même sur les souches virales actuellement résistantes.
Les inhibiteurs de la transcriptase inverse
Les médicaments de la classe des inhibiteurs de la transcriptase inverse se répartissent en trois groupes : Les analogues nucléosidiques, analogues non nucléosidiques, analogues nucléotidiques. Ils agissent tous selon le même principe, qui est de bloquer la transformation de l'ARN en ADN. L'AZT qui a été la première molécule anti-VIH commercialisée fait partie de la classe des inhibiteurs nucléosidiques. Dans la plupart des cas, ces molécules nécessitent d'être activées par l'organisme avant de pouvoir jouer leur rôle anti-viral.
Un vaccin ?
Différents vaccins ont été ou sont en cours de test chez l'Homme. Jusqu'à présent, les résultats ont plutôt été encourageants chez l'animal, mais décevant chez l'Homme. Actuellement, on s'oriente vers un vaccin combiné, qui non seulement présenterait les antigènesantigènes du virus, mais aussi stimulerait le système immunitaire. Les chercheurs espèrent aussi pouvoir mettre au point un vaccin thérapeutique, qui permettrait de soigner les malades et non pas uniquement de protéger les personnes non infectées. La grande variabilité des protéines du virus constitue un des obstacles majeurs pour l'obtention d'un vaccin efficace.
L'ARN interférence
L'ARNi est une technique de choix pour inactiver spécifiquement certains gènesgènes dans une cellule. Cette inactivation est basée sur l'utilisation de petits ARN anti-sens, qui vont s'hybrider avec l'ARN viral, et le rendre ainsi totalement inactif. Des tests ont montré que des cellules immunitaires (CD34+), qui sont les cellules précurseurs des lymphocytes TT, exprimant des ARNi dirigés conte le VIH, donnaient, après différenciation, des lymphocytes résistants au virus. Bien sûr, ces résultats sont très préliminaires, mais ils permettent d'entrevoir de futures approches très prometteuses.










![Sidaction 2004 : Le VIH a 21 ans, retour sur une épidémie [1/3] Sidaction 2004 : Le VIH a 21 ans, retour sur une épidémie [1/3]](https://cdn.futura-sciences.com/cdn-cgi/image/width=430,quality=60,format=auto/sources/images/actu/img/sida.jpg)