au sommaire

Les anticorps peuvent désormais franchir la barrière hémato-encéphalique pour agir directement dans le cerveau ! © DR
- Découvrez notre dossier sur la maladie d'Alzheimer

Le cerveau est doté d'une barrière, appelée hémato-encéphaliquehémato-encéphalique (entre le sang et le cerveau), qui offre l'avantage de filtrer efficacement l'entrée des moléculesmolécules ou des virus et des bactéries, afin de limiter au maximum la survenue d'infections ou de dommages. Mais ce système biologique plutôt bien rodé possède malheureusement un désavantage de taille : celui de ne pas laisser diffuser de nombreuses molécules thérapeutiques qui pourraient soigner certaines maladies du système nerveux central.
Cette étanchéitéétanchéité entre les vaisseaux sanguins et le cerveau est permise par la forte agrégation des cellules qui constituent la paroi du système vasculaire. Les cellules endothéliales sanguines sont en effet collées les unes aux autres grâce à la présence de nombreuses jonctions serrées, des sortes de boutons-pressionspressions qui rendent imperméable l'espace intercellulaire, sauf à de toutes petites molécules comme l'eau. Pour être nourri et oxygéné mais aussi pour se débarrasser de ses déchetsdéchets, le cerveau doit donc malgré tout permettre un passage au travers des cellules endothéliales sanguines, grâce à des systèmes très contrôlés de transport intracellulaire actifs ou passifs.
Bloquer la β-sécrétase
Difficile, dans ces conditions, d'envoyer vers le cerveau de très grosses molécules, comme des anticorps, dont le poids moléculaire avoisine les 150 kilodaltons (soit plus de huit cents fois le poids moléculaire d'une molécule de glucoseglucose !). Pourtant, les anticorps semblent avoir le potentiel nécessaire à la lutte contre la maladie d’Alzheimer, là où d'autres molécules ne se sont finalement révélées que peu efficaces ou à l'origine d'effets indésirables. Et pour cause, les anticorps agissent de façon extrêmement spécifique puisqu'ils ne reconnaissent qu'un antigèneantigène unique.
Ainsi, ils seraient parfaits pour empêcher spécifiquement l'action de la β-sécrétase, l'enzymeenzyme qui produit les peptidespeptides β-amyloïdes, par coupure d'une protéineprotéine plus grande (la protéine précurseur de la protéine β-amyloïde). Elle est ainsi impliquée dans l'accumulation des plaques séniles dans le cerveau, caractéristiques de la maladie neurodégénérativemaladie neurodégénérative, et constitue une cible thérapeutique idéale.
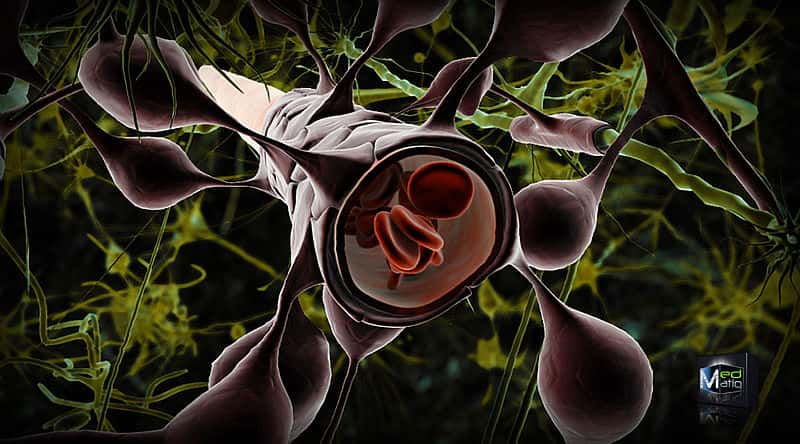
Les astrocytes, qui entourent les vaisseaux sanguins dans le cerveau, participent aussi à la régulation de l'étanchéité de la barrière hémato-encéphalique. © Ben Brahim Mohammed, Wikimedia, CC by 3.0
Un anticorps à deux bras différents
Deux équipes de scientifiques américains de la société Genetech ont publié simultanément leurs résultats dans la revue Science Translational Medicine, concernant une méthode non conventionnelle de traitement de la maladie d’Alzheimer. Elles se sont en effet focalisées sur la production d'un anticorps monoclonalmonoclonal humain (dont toutes les molécules sont identiques) un peu particulier, puisqu'il possède deux bras différents, chacun capable de reconnaître un antigène particulier (alors qu'un anticorps classique possède deux bras identiques).
Le premier bras a été conçu pour reconnaître spécifiquement et inhiber l'activité de la β-sécrétase. D'ailleurs, injecté chez des souris et des primatesprimates non humains, cet anticorps est non seulement très spécifique puisqu'il ne s'attaque qu'à la β-sécrétase 1 (et pas à la β-sécrétase 2 ni à la cathépsine D, des enzymes pourtant très proches), mais en plus il réduit efficacement la quantité de peptides β-amyloïdes dans l'organisme, et dans une moindre mesure dans le cerveau.
Une question d’équilibre
Pour forcer l'entrée de l'anticorps anti-β-sécrétase dans le cerveau, la seconde équipe s'est intéressée à l'amélioration du second bras de l'anticorps. S'inspirant du mode d'entrée des atomesatomes de ferfer dans le cerveau, qui sont transportés au travers de la barrière hémato-encéphaliquebarrière hémato-encéphalique par une enzyme, la transferrine, les chercheurs ont doté l'anticorps d'un bras qui reconnaît ce transporteur. Mais tout est une question d'équilibre : si la reconnaissance est trop forte, l'anticorps reste fixé à la transferrine, sans parvenir jusqu'au cerveau.
Les chercheurs ont donc tenté de diminuer l’affinité de l’anticorps pour l’enzyme. Et cette technique a l'airair de fonctionner ! Les anticorps sont donc toujours transportés par la transferrine, mais peuvent être relargués dès la barrière franchie. Ils sont ainsi dix fois plus nombreux à pouvoir se diriger dans le cerveau... et surtout, ils y diminuent de moitié la quantité de peptides amyloïdes !
Si ces résultats encourageants se confirment sur l'Homme, ils pourraient avoir un impact énorme sur les futures stratégies thérapeutiques, aussi bien sur la maladie d'Alzheimermaladie d'Alzheimer que sur beaucoup d'autres maladies, où les cibles sont également situées dans le cerveau.