au sommaire
Un même défaut dans les neurones pourrait expliquer les maladies à prions et Alzheimer. © Mark Lythgoe, Chloe Hutton, Wellcome Images, Flickr, cc by nc nd 2.0
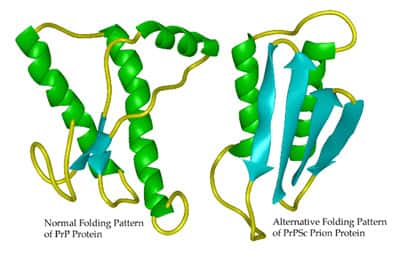
Les maladies à prions (maladie de Creutzfeldt-Jakob chez l'Homme) et la maladie d'Alzheimer sont associées à l'accumulation dans le cerveau de protéines anormales : la protéine prion scrapie (PrPSc) dans le cas des maladies à prions et les peptidespeptides amyloïdes Aβ dans la maladie d’Alzheimer. Ces deux moléculesmolécules exercent un effet toxique dans le cerveau en provoquant la mort des neuronesneurones, à l'origine des principaux signes cliniques caractéristiques de ces maladies.
Depuis quelques années, il est connu que la production des protéines pathologiquespathologiques PrPSc et Aβ40/42 a pour origine un défaut du clivageclivage physiologique de la protéine prion entière non pathologique (PrPCPC) ou de la protéine précurseur des peptides amyloïdes (APP). Cependant, on ne savait pas, jusqu'alors, expliquer pourquoi ce clivage, qui normalement protège les neurones, est altéré dans les maladies à prions et la maladie d'Alzheimer.
Aujourd'hui, les travaux menés par Benoit Schneider, chercheur CNRS de l'unité Inserm 747 (« Cellules souches, signalisation et prions », université Paris Descartes) et Jean-Marie Launay (unité Inserm 942, Hôpital Lariboisière), en collaboration avec d'autres équipes françaises travaillant sur les prions, viennent d'identifier une chaîne de réactions qui bloque le clivage bénéfique de la PrPC et de l'APP par l'alpha-sécrétase Tace (acronyme de l'anglais TNF Alpha Converting EnzymeEnzyme). Les chercheurs dévoilent dans Nature Medicine comment la dérégulation de Tace contribue à la neurodégénérescence en provoquant l'accumulation des protéines pathologiques PrPSc et Aβ40/42 et en exacerbant la sensibilité des neurones à l'inflammationinflammation.
PDK1 bloquée, les neurones de nouveau protégés
Dans des conditions physiologiques normales, Tace est présente à la surface des neurones, où elle exerce son activité de clivage à la fois vis-à-vis de la PrPC, de l'APP et des récepteurs au facteur inflammatoire TNF (TNFR), ce qui limite considérablement la production des protéines pathologiques PrPSc et Aβ et protège les neurones des effets délétères induits par TNF.
La suractivation de PDK1 favorise l'apparition des protéines néfastes pour la survie des neurones, comme les prions PrPSc et les Aβ40/42. © Med. Mic. Sciences Cardiff University, Wellcome Images, cc by nc nd 2.0
Dans les neurones infectés par les prions pathogènespathogènes comme dans les neurones « Alzheimer », la protéaseprotéase Tace n'est plus localisée à la surface cellulaire, mais est séquestrée à l'intérieur des neurones. Cette internalisation empêche Tace de cliver ses substratssubstrats et d'exercer son activité neuroprotectrice. Les chercheurs montrent pour la première fois que la kinasekinase PDK1 joue un rôle clé dans le contrôle de la localisation de Tace. La suractivation de PDK1 est responsable de la séquestration de Tace dans les neurones malades (infectés par les prions et Alzheimer) comme dans le cerveau des patients atteints de la maladie d'Alzheimer.
Le blocage pharmacologique de PDK1 renvoie Tace à la surface des neurones et restaure son rôle neuroprotecteur. L'inhibitioninhibition de PDK1 parvient à protéger les neurones de la neurodégénérescence en restaurant les clivages physiologiques de la PrPC, APP et TNFR par Tace.
Vous reprendrez bien une Tace
« Grâce à nos travaux sur l'infection par les prions, nous avons pu identifier PDK1 comme une nouvelle cible thérapeutique non seulement pour la maladie de Creutzfeldt-Jakob mais aussi pour la maladie d'Alzheimer », expliquent les chercheurs.
L'action de PDK1 sur Tace a été mise en évidence in vitroin vitro sur une lignée neuronale et des cultures de neurones provenant du cerveau de souris après infection par les prions, puis in vivoin vivo sur des modèles animaux. Un traitement par un inhibiteur pharmacologique de PDK1 permet d'atténuer les déficits moteurs et de prolonger la duréedurée de vie des souris infectées par les prions pathogènes. Ensuite, en exploitant trois modèles de souris « Alzheimer », les chercheurs ont montré que ce traitement réduit aussi les troubles cognitifs des animaux, et ils identifient PDK1 comme une cible thérapeutique pour la maladie d'Alzheimer.
Une solution d’avenir contre Alzheimer et Creutzfeldt-Jakob
« Étant donnée la rareté et l'efficacité réduite des traitements disponibles pour lutter contre les maladies à prions et la maladie d'Alzheimer, ces résultats offrent de nouvelles perspectives thérapeutiques pour le traitement de ces maladies neurodégénératives », concluent les chercheurs.
Ces travaux apportent un nouvel éclairage sur les mécanismes de neurodégénérescence induits par l'accumulation de protéines anormales. L'enjeu est maintenant de comprendre comment ces protéines toxiques conduisent à la dérégulation de PDK1, ce qui permettra d'identifier d'autres acteurs, c'est-à-dire de nouvelles cibles thérapeutiques potentielles, qui contribuent à la dégénérescence neuronale.