Si la génétique semble être l’un des facteurs de risque de développement de la maladie de Parkinson, elle expliquerait aussi sa progression, selon des chercheurs australiens. Cependant, une autre étude, américaine celle-là, vient en parallèle de montrer comment reprogrammer en laboratoire des cellules cérébrales – des astrocytes – pour les transformer en véritables usines à dopamine et ouvre de nouvelles perspectives thérapeutiques.
au sommaire
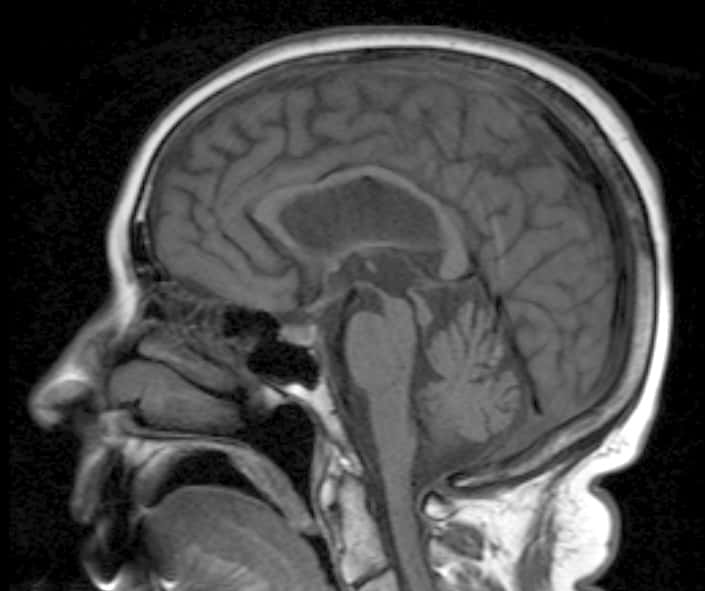
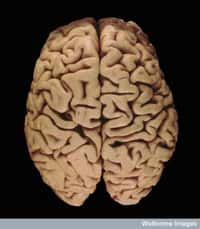
La maladie de Parkinson est l'une des maladies neurodégénératives les plus fréquentes, juste après la maladie d'Alzheimer. © Dr. Laughlin Daves, radpod
- À lire, le dossier sur la maladie de Parkinson
La maladie de Parkinson reste encore très mystérieuse. Elle se caractérise entre autres par l'accumulation anormale d'une protéine, l'alpha-synucléine, au niveau d'une région cérébrale médiane appelée substantia nigrasubstantia nigra (ou substance noire). Cette pathologie conduit à la mort précoce des neurones chargés de produire la dopamine, un neurotransmetteur indispensable aux régulations motrices.
On savait que la génétique constituait l'un des facteurs de risquefacteurs de risque de développer la maladie, puisqu'environ 15 % des personnes atteintes ont également un proche affecté. Désormais, il a été montré par des chercheurs australiens de l'université de Nouvelle-Galles du Sud que le génotypegénotype peut aussi influer sur la vitessevitesse de la progression de la maladie.
Alpha-synucléine : le bon dosage contre Parkinson
Grâce aux données émanant de 123 patients atteints par la maladie de Parkinson, les résultats publiés dans le Journal of Parkinson’s disease ont montré qu'il existait un lien entre la région promotrice du gènegène de l'alpha-synucléine (NACP-Rep1) et la protéine Tau, qui joue un rôle crucial dans le maintien de la structure des cellules. On connaissait déjà le rapport de cette structure avec la pathologie puisque l'étude postmortem des cerveaux des personnes affectées montrait des agrégats de cette protéine dans les régions cérébrales affectées par la neurodégénérescence. Mais pour l'heure, on ne peut pas dire si elle en est l'une des causes ou simplement une conséquence.
Les chercheurs ont comparé les interactions entre les trois versions de NACP-Rep1 avec l'allèle H1 du gène de la protéine Tauprotéine Tau. Résultat, les patients ayant un seul allèleallèle 0 (0 signifiant faible synthèse) de NACP-Rep1 développent la maladie moins rapidement que ceux qui ne portent pas cet allèle ou qui le portent sur les deux chromosomeschromosomes, démontrant malgré tout une implication de l'alpha-cystéinecystéine dans la vitesse de progression de la pathologie.
S'il n'est pas surprenant de constater qu'une haute expression de l'alpha-synucléine favorise le développement de la maladie, les auteurs s'attendaient moins à constater qu'une synthèse peu importante engendrait les mêmes effets. Cela remet donc en cause les thérapiesthérapies visant à abaisser les taux d'alpha-synucléine.
Cependant, l'allèle H1 joue lui aussi un rôle dans la vitesse de propagation de la maladie. Lorsqu'il est absent, les personnes au génotype 0/0 pour NACP-Rep1 voient la maladie se développer beaucoup moins vite que lorsqu'ils sont porteurs d'H1. Il existe donc un lien entre l'alpha-synucléine et la protéine Tau qui varie en fonction des différents allèles présents dans le génotype.
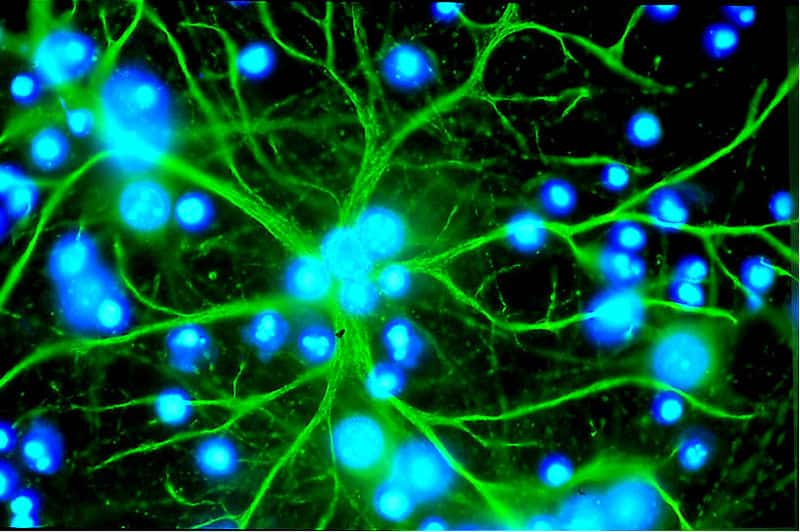
Astrocyte deviendra neurone dopaminergique
Parallèlement, des chercheurs de l'université de Pennsylvanie (États-Unis) annoncent avoir réussi à reprogrammer in vitroin vitro des astrocytesastrocytes en neurones dopaminergiques (synthétisant beaucoup de dopaminedopamine). Ces premières sont des cellules glialescellules gliales du cerveaucerveau en forme d'étoileétoile, chargées d'assurer la protection des cellules nerveuses. Les résultats ont été publiés sur Plos One.
En utilisant un rétrovirusrétrovirus, les Américains ont injecté 3 facteurs de transcriptionstranscriptions dans les astrocytes (ASCL1, LMX1B et NURR1), les transformant en usines à produire de la dopamine. Au final, 18 % de ces cellules se sont montrées effectives deux semaines après le traitement.
Ces dernières années, si des pistes proches avaient été envisagées, elles faisaient appel aux cellules-souches, d'origine embryonnaire. Or, cela soulève des questions éthiques non résolues, et la greffegreffe cellulaire ne réussit pas toujours. Les auteurs ont donc envisagé une nouvelle voie, et Russell Addis, l'un des auteurs, se félicite de figurer parmi les premiers à réussir ce genre de performance. « Cela ouvre les portesportes à de nouvelles stratégies de reprogrammation cellulairereprogrammation cellulaire pour traiter la maladie de Parkinson. » La prochaine étape consiste à vérifier si l'on observe le même phénomène dans un cerveau vivant.