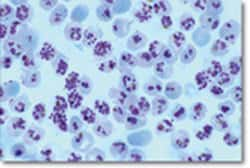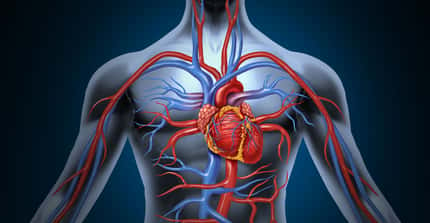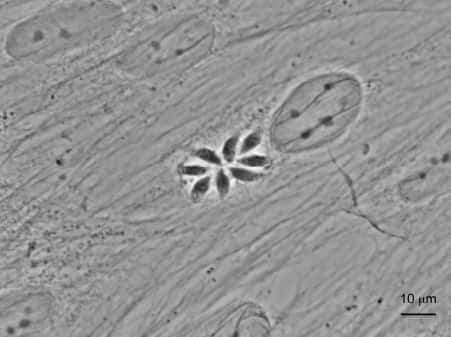
Image microscopique d’une cellule humaine infectée par Toxoplasma gondii avec la formation d’une rosette de 8 parasites. Crédit CNRS/Inserm
Responsables du paludisme (ou malariamalaria) et de la toxoplasmose, les parasitesparasites Toxoplasma et Plasmodium sont des apicomplexés (ou sporozoaires). Ces petits êtres unicellulaires, tous parasites d'animaux, sont caractérisés par un cycle de vie particulièrement complexe qui alternealterne entre prolifération intense et différenciation et s'effectue souvent chez plusieurs hôtes. Cette succession de modes de vie nécessite un contrôle rigoureux des gènes, dont les mécanismes restent très mal connus.
Les membres de l'équipe du laboratoire Adaptation et pathogénie des micro-organismes, coordonnée par Mohamed-Ali Hakimi, chargé de recherches à l'université Joseph FourierJoseph Fourier de Grenoble, pensent que le savoir-faire des apicomplexés pour changer plusieurs fois de manière de vivre réside dans la structure des chromosomes et le contrôle de l'expression des gènes. Il s'agit donc pour eux d'un phénomène épigénétique, c'est-à-dire de mécanismes qui influent sur la manière dont les gènes sont utilisés. Ces biologistes se sont penchés plus précisément sur les histoneshistones, ces petites protéinesprotéines accrochées à l'ADNADN et qui permettent de délier les chromosomes pour former la chromatinechromatine. Leurs résultats prometteurs viennent d'être publiés dans la revue The Journal of Experimental medicine.
Un champignon montre la voie
Pour conduire ces modifications des chaînes d'ADN, que l'on appelle la condensationcondensation, ces histones changent de structures. Or, on connaît certaines moléculesmolécules capables d'affecter ces modifications structurales des histones donc, au final, d'agir sur le niveau de condensation de la chromatine.
Une de ces molécules s'est avérée particulièrement intéressante. Il s'agit de FR23522, un peptide (une courte chaîne d'acides aminésacides aminés), de forme cyclique, produit par un champignonchampignon filamenteux. Elle a la propriété d'inhiber un certain type d'enzymesenzymes, les histones désacétylases, elles-mêmes capables d'accroître le niveau de condensation de certains niveaux de la chromatine.
Par son action, le peptide FR23522 modifie l'expression d'une série de gènes, 369 sur un total estimé à 7.817, soit 5%, manifestement impliqués dans l'action parasitaire. L'introduction de ce peptide dans une culture provoque en effet la différenciation de la forme réplicative (ou tachyzoïte) du parasite, qui se transforme alors en bradyzoïte, c'est-à-dire la forme non réplicative. La prolifération du parasite est ainsi limitée voire complètement inhibée.
Les biologistes ont commencé à comprendre le mode d'action de FR23522. Son effet serait favorisé par la présence d'un certain acide aminé sur le site actifsite actif d'une enzyme de type histone désacétylase. D'après les auteurs, ce mécanisme n'existe que chez les apicomplexés.
Connaissant ces mécanismes, il devrait être possible de produire des molécules analogues au peptide FR23522, pour en faire des médicaments capables d'enrayer efficacement le développement de l'infection. C'est l'objectif actuel de l'équipe.