au sommaire
L'ADN de l'embryon contient les instructions pour la constructionconstruction de l'organisme humain mais, parfois, l'embryon ne se développe pas correctement et est éliminé lors d'une fausse couche. En France, d'après l'Inserm, lorsqu'un couple a recours à la procréation médicalement assistée (PMA), les chances de grossesse sont estimées à 13 à 30 % par tentative. Pour mieux comprendre ces échecs du développement embryonnaire, des chercheurs britanniques souhaitent modifier génétiquement des embryons humains par la technique d'édition de gènes.
Cette technique de manipulation de l'ADN a déjà beaucoup fait parler d'elle en 2015 lorsque des chercheurs chinois ont annoncé qu'ils l'avaient utilisée avec succès pour corriger un gène responsable d'une maladie (la bêta-thalassémiebêta-thalassémie) dans des embryons humains. Cette fois, c'est au Royaume-Uni que l'édition génétiquegénétique va être utilisée, en toute légalité, sur des embryons humains. L'autorité régulatrice britannique, la Human Fertilisation and Embryology Authority (HFEA) a donné son accord le 1er février 2016 et les expériences pourraient commencer dans les prochains mois.
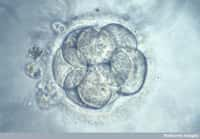
Cette recherche, qui vise à mieux comprendre les premiers instants de la vie, sera menée par Kathy Niakan qui utilisera la technique CRISPR-Cas9 sur des embryons humains en bonne santé. L'objectif de ces travaux est d'inactiver des gènes intervenant dans le développement embryonnaire précoce, dans les premiers jours suivant la fécondationfécondation. Les chercheurs arrêteront les expériences au bout de sept jours, quand le blastocysteblastocyste contiendra au maximum 256 cellules, et les embryons seront détruits.
Après la fécondation, l'œuf évolue au stade blastocyste, dont certaines cellules ont des rôles particuliers : certaines vont former le placentaplacenta, d'autres le sac vitellinsac vitellin, d'autres encore l'organisme proprement dit (le fœtusfœtus) mais la façon dont tout cela s'organise durant la grossesse est encore mal connue. Or, certaines régions de l'ADN sont très actives à cette étape : des gènes doivent donc diriger ce développement précoce.
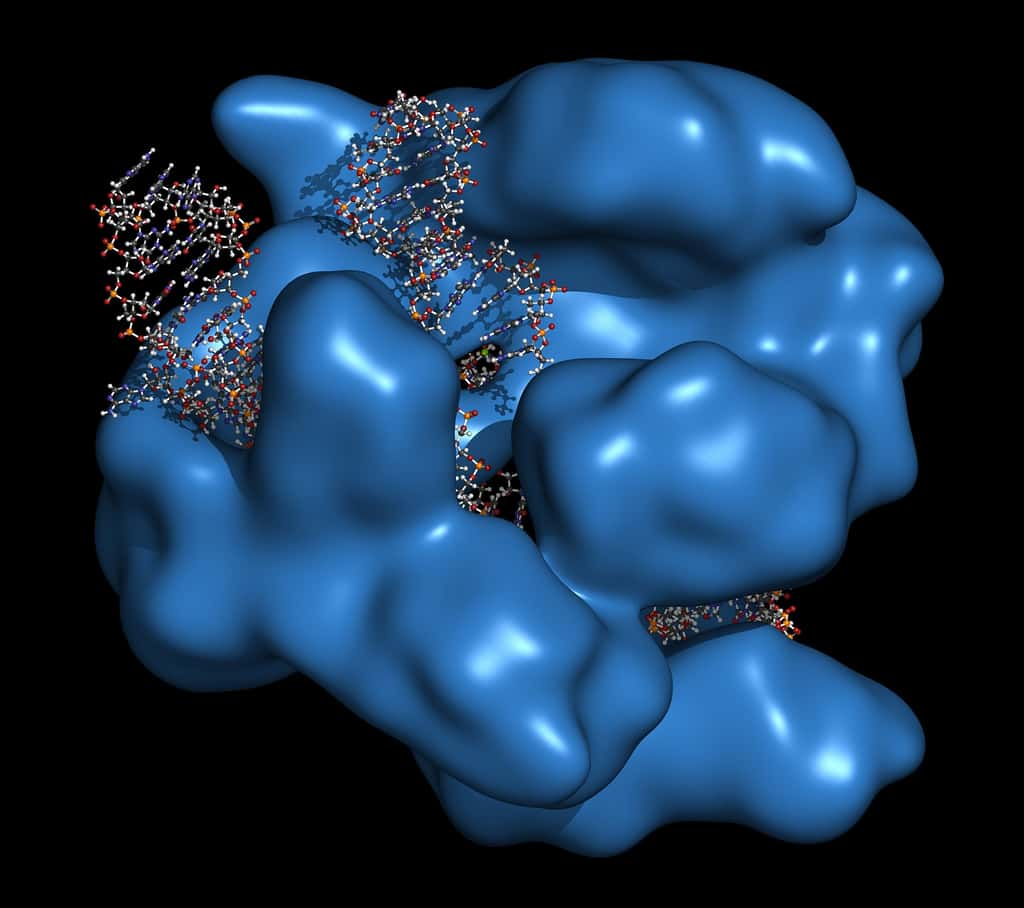
Cas9 est une enzyme d’origine bactérienne qui peut couper l’ADN en des points précis. Le système CRISPR-Cas9 permet de modifier facilement le génome. © molekuul.be, Shutterstock
Bioéthique : la crainte de bébés génétiquement modifiés
Précédemment, Kathy Niakan a expliqué pourquoi elle avait besoin d'utiliser l'édition génétique pour sa recherche : « Nous aimerions vraiment comprendre les gènes nécessaires pour qu'un embryon humain se développe avec succès et donne un bébé en bonne santé. La raison pour laquelle c'est si important est que les fausses couchesfausses couches et l'infertilitéinfertilité sont extrêmement fréquentes, mais ne sont pas très bien comprises ». Plus précisément, les premières expériences serviraient à inactiver le gène OCT4, aussi connu sous le nom de POU5F1, qui est actif dans les cellules qui formeront le fœtus.
Paul Nurse, directeur de l'Institut Francis CrickFrancis Crick, s'est réjoui de la décision de la HFEA sur le site de la BBC : « Je suis ravi que la HFEA ait approuvé la demande du docteur Niakan. La recherche proposée [...] est importante pour comprendre comment un embryon humain en bonne santé se développe et permettra d'améliorer notre compréhension des taux de succès des FIV [Fécondation in vitro, NDLRNDLR], en regardant le stade le plus précoce du développement humain ».
Cependant, cette décision suscite des craintes quant à la possibilité de créer des bébés génétiquement modifiés car une nouvelle étape est franchie. D'autres scientifiques ont réagi à cette annonce, comme Sarah Chan de l'université d'Edimbourg : « L'utilisation des technologies de l'édition du génomeédition du génome dans la recherche sur l'embryon touche à des questions sensibles, il est donc approprié que cette recherche et ses implications éthiques aient été soigneusement examinées par la HFEA avant qu'elle ne donne l'autorisation de continuer ».
Tetsuya Ishii, un expert en bioéthique de l'université d'Okkaido à Sapporo au Japon, s'exprime dans Nature sur cette décision britannique : « Cette mesure au Royaume-Uni va stimuler le débat sur la réglementation juridique de l'édition génétique germinale dans les milieux cliniques ».