au sommaire
Le paludisme tue toujours. En 2010, 655.000 personnes en sont mortes à travers le monde, principalement en Afrique subsaharienne. La maladie s'attrape lorsqu'un moustique transmet, lors de la piqûre, un protozoaire parasiteparasite du genre Plasmodium. Cinq de ses espècesespèces induisent la pathologie, mais la forme la plus dangereuse est causée par le Plasmodium falciparum.
Lorsqu'il s'agit de se débarrasser d'un parasite, la médication est plutôt difficile car il faut cibler l'ennemi sans dérégler l'organisme hôte en lui infligeant des effets secondaires importants. Certains traitements antipaludéens commencent de plus à atteindre leurs limites du fait de la résistancerésistance du Plasmodium.
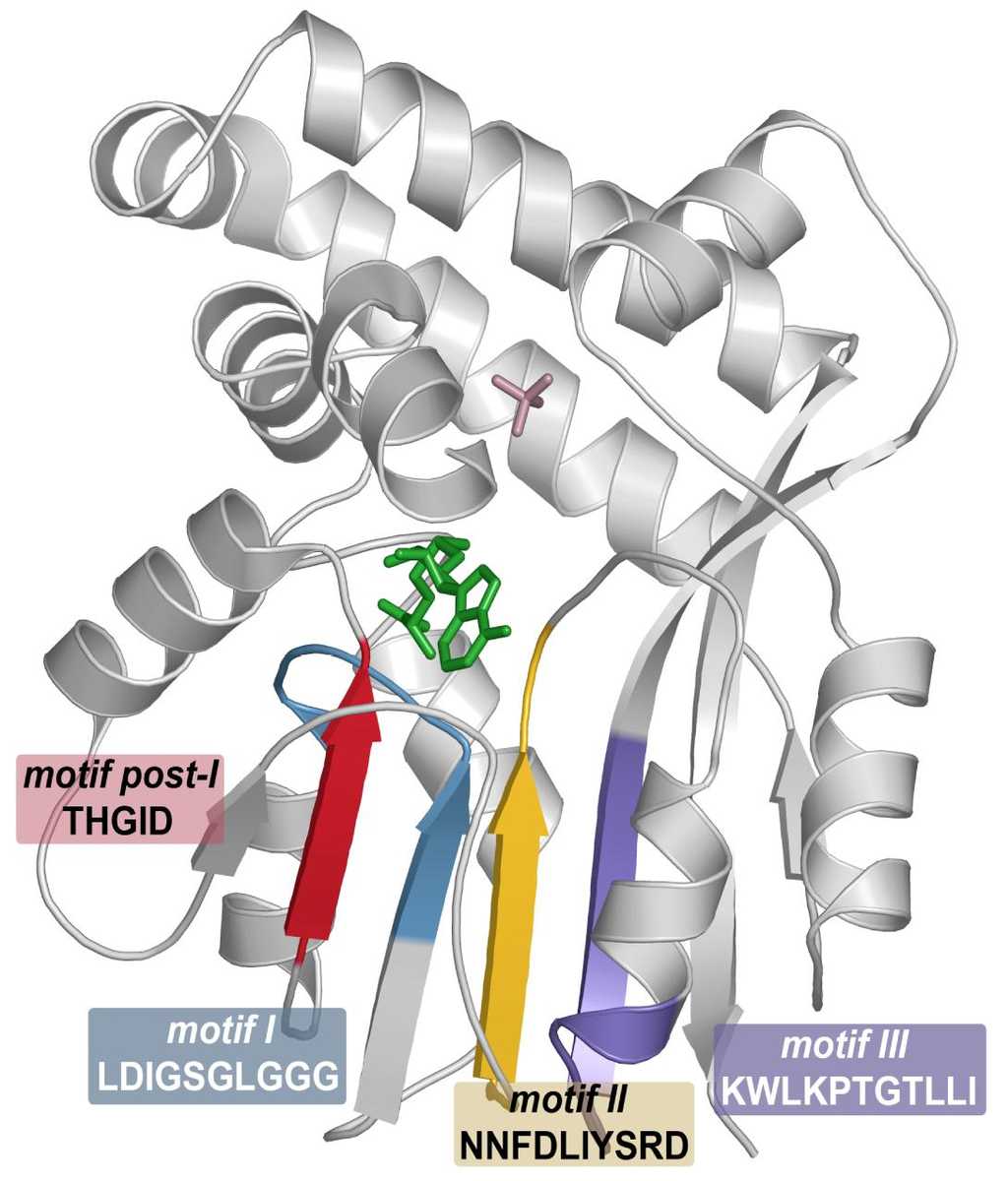
Les scientifiques souhaitent trouver une médication qui ne s'attaquera qu'au parasite et non à son hôte. Désormais, ils ont une nouvelle cible dans le viseur depuis que des chercheurs de l'université Washington de Saint-Louis (États-Unis) ont publié dans le Journal of Biological Chemistry la structure tertiaire de l'enzyme PMT (pour phosphoéthanolamine méthyltransférase), indispensable à la survie du Plasmodium mais inexistante chez l'Homme. Son rôle est de rajouter des groupements méthyls à une moléculemolécule appelée phosphoéthanolamine.
Du cristal de PMT
Parce que cette PMT est indirectement impliquée dans la synthèse de la membrane plasmique du parasite, il ne peut survivre sans. Cela se sait depuis des années mais pour l'inactiver, mieux vaut connaître sa structure. Depuis six ans, Joseph Jez et son équipe ont tenté de la matérialiser sans succès. Cette fois, ils ont réussi...
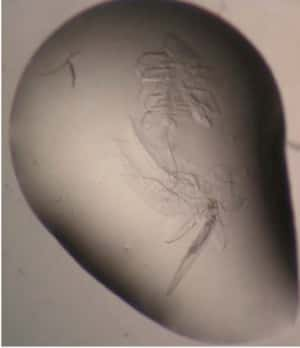
Si cela ressemble fortement à un moustique englué dans de l'ambre, il s'agit en réalité de cristaux protéiques obtenus lors de l'expérience, dont le but est de trouver de nouveaux moyens de lutte contre le paludisme. © Jez et al.
Pour cela, ils ont tenté de cristalliser l'enzymeenzyme en question pour ensuite en déduire sa structure tridimensionnelle, mais la technique est assez complexe. La cristallisation consiste en la déshydratationdéshydratation d'une gouttelette composée de protéines purifiées pour que ces protéinesprotéines finissent petit à petit par s'agglomérer entre elles. Elles ne le font pas de manière anarchique : elles se placent les unes au bout des autres, de telle sorte que les structures microscopiques se reflètent à l'échelle macroscopique.
De la 3D pour mieux contrer le paludisme
Une fois les protéines cristallisées, les chercheurs ont utilisé la technique de cristallographiecristallographie par rayons Xrayons X pour visualiser la structure tridimensionnelle de l'édifice. Il s'agit de calculer la position des atomes dans l'espace par la réflexion des rayons sur les électronsélectrons. Grâce à une cristallisation de qualité, ils ont pu établir le profil tridimensionnel de la PMT.
« Nous pensons que l'enzyme a un couvercle qui s'ouvre et se referme, déclare Joseph Jez. Le site actifsite actif reste ouvert jusqu'à ce que les substratssubstrats soient entrés, ils sont regroupés ensemble quand le couvercle tombe [et on obtient ainsi le produit de la réaction enzymatiqueenzymatique]. »
Maintenant que la PMT n'a plus de secret, la possibilité d'élaborer un médicament qui la ciblerait spécifiquement est une opportunité plus crédible. Mais il reste encore beaucoup de chemin à parcourir...