au sommaire
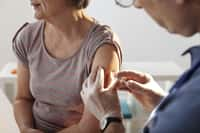
Des vaccins sans doute prêts au début de l'automne, dont certains, pour aller plus vite, sont dérivés de celui dirigé contre le virus de la grippe aviaire. © Dron / Fotolia
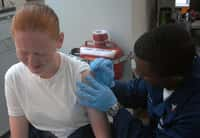
L'Organisation mondiale de la SantéOrganisation mondiale de la Santé (OMS) a laissé entendre hier, que les premiers lots de vaccins contre la grippe A(H1N1)grippe A(H1N1) seraient probablement disponibles pour le courant du mois de septembre 2009. Une déclaration très attendue, compte-tenu de la situation épidémiologique mondiale. Quatre producteurs sont sur la ligne de départ : l'américain Baxter, le britannique GlaxoSmithKline (GSK), le français Sanofi Pasteur et le suisse Novartis (ex-Chiron).
Le candidat-vaccin de Baxter, le Celvapan, est en fait une version adaptée du vaccin pré-pandémique initialement mis au point contre le virus aviaire A(H5N1). Ce prototype disposait déjà d'une Autorisation de Mise sur le MarchéAutorisation de Mise sur le Marché (AMM) accordée par l'Agence européenne pour l'Evaluation des Médicaments (EMEA). « Il a juste fallu remplacer la souche H5N1 par H1N1 » nous a précisé Vincent Vanwijnsberghe, un des responsables de la communication. Le gain de temps est évident. « Ce procédé permet une autorisation accélérée du vaccin pandémique, sans déposer une nouvelle demande d'AMM. »
Toujours dans le but de raccourcir les délais de production, Baxter recourt à la culture cellulaire, alors que les autres producteurs utilisent des œufs embryonnés de poules pour cultiver le virus. « Cette technique de culture sur cellule Vero - il s'agit d'un procédé breveté qui utilise des cellules de rein de singe vert africain - permet de travailler sur des souches virales entières, poursuit Vincent Vanwijnsberghe. Aucun besoin de les transformer. Cette technologie permet de multiplier en laboratoire la souche virale A(H1N1), sans ajout de sérum animal. Le rendement de production est ainsi plus élevé. »
Des stratégies différentes
Résultat, « plusieurs lots industriels du Celvapan peuvent aujourd'hui être commercialisés. Nous avons déjà passé des accords avec le Royaume-Uni, l'Irlande et la Nouvelle Zélande ». Deux autres Etats - que le représentant de Baxter refuse de nommer « car ils n'ont pas encore communiqué sur le sujet » -, auraient en outre passé commande de ce vaccin.
GSK dispose aussi d'un vaccin pré-pandémique, le prepandrix. Il a lui aussi été développé contre le virus aviaire A(H5N1) et bénéficie déjà d'une AMM depuis l'an dernier. Il s'agit d'un vaccin grippal avec adjuvantadjuvant. Le laboratoire a commencé la production, après avoir remplacé la souche A(H5N1) par A(H1N1), exactement comme son concurrent américain.
Contrairement aux autres fabricants, Sanofi Pasteur ne joue pas la carte du vaccin pré-pandémique prêt à l'emploi. Dans une interview à Destination Santé le 6 juin 2008 déjà, ses représentants affirmaient « ne pas y croire. (...) C'est en réduisant la duréedurée de production des vaccins que nous gagnerons la bataille contre une pandémiepandémie grippale », assurait le Dr Albert Garcia, alors porteporte-parole du pôle Préparation pandémique de Sanofi Aventis.
Il s'agit là d'une véritable différence d'approche, à tel point que le leader mondial suit, seul, la voie d'un vaccin pandémique monovalent sans adjuvant. « Les essais cliniquesessais cliniques ont débuté hier aux Etats-Unis. Ils portent sur près de 2.000 personnes » précise le directeur de la Communication, Benoît Rungeard.
Parallèlement, le laboratoire annonce le dépôt « d'un complément de dossier d'enregistrement [qui se rapporte à l'évaluation de son vaccin, NDLRNDLR] auprès de la Food and Drug AdministrationFood and Drug Administration (FDA) américaine ». Une fois le feufeu vert accordé, les choses pourraient aller très vite. « Si tout va bien, nous serons prêts pour l'automneautomne » assure Benoît Rungeard.