au sommaire
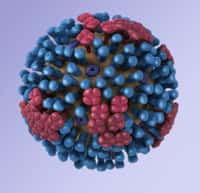
Le virus de la grippe, représenté ici à l'image, réussit à s'adapter aux médicaments et contourne les molécules qu'on lui oppose. Mais pourra-t-il se défaire facilement des DFSA ? © Anna Tanczos, Wellcome Images, Flickr, cc by nc nd 2.0
- À lire, notre dossier complet sur la grippe
La grippe n'a rien d'anodin. Chaque année dans le monde, elle cause la mort de 250.000 à 500.000 personnes. Heureusement, il existe des traitements contre cette infection virale, le Tamiflu et le Relenza en tête.
Ces médicaments agissent en bloquant une enzymeenzyme essentielle au virus, la neuraminidase. Elle lui est indispensable pour se répandre de cellule en cellule car, lié à son hôte par une moléculemolécule d'acideacide sialique, il compte sur cette protéine active pour se libérer. Les deux principes actifs ont une affinité particulière pour la neuraminidase, empêchant son action dès qu'ils rentrent en contact.
Mais le virus de la grippe a plus d'un tour dans son sac. Certaines souches ont réussi à s'adapter en changeant la séquence enzymatiqueenzymatique, permettant à la neuraminidase de conserver sa fonction sans être la cible des médicaments. Un phénomène de résistance se met en place, contre lequel les scientifiques peinent à trouver une solution.
Plus d’affinité avec la neuraminidase pour la faire taire
Mais la situation pourrait s'arranger, à en croire une étude internationale dirigée par des chercheurs de l'université de la Colombie-Britannique, à Vancouver (Canada). Ils viennent de développer de nouveaux composés, de la famille des acides difluorosialiques (difluorosialic acid en anglais, raccourci en DFSA) qui se montrent au moins aussi efficaces que les traitements classiques, tout en limitant les risques de résistance.
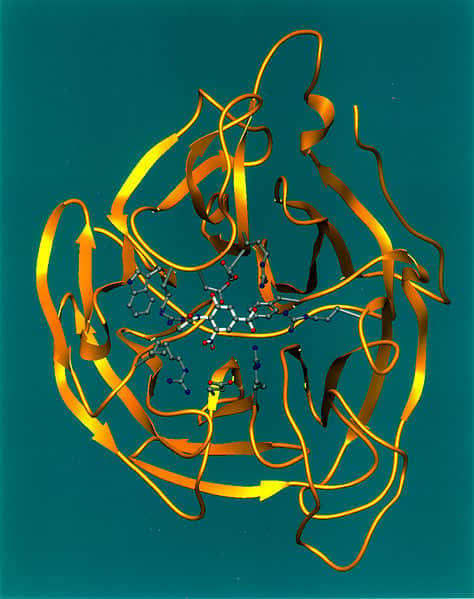
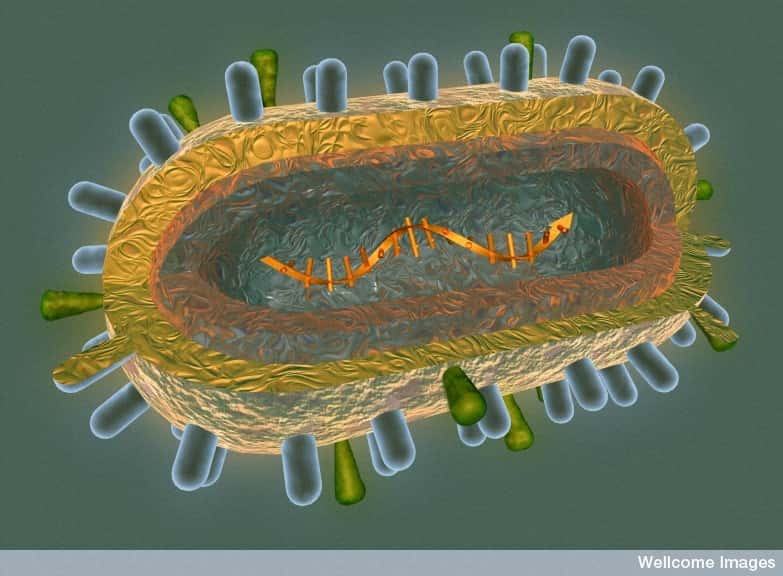
La neuraminidase, cette enzyme ici en jaune, correspond au fameux N qui accompagne toujours le nom de la souche (comme H5N1). Il en existe de neuf sortes et elle joue un rôle clé dans l'expansion du virus de la grippe. © Nasa, Wikipédia, DP
Comme expliqué dans la revue Science, ces nouveaux médicaments s'en prennent eux aussi à l'activité de la neuraminidase. Mais parce qu'ils sont dotés d'une structure plus proche de l'acide sialique, la cible classique de l'enzyme, que ces concurrents actuellement sur le marché, les scientifiques espèrent que le virusvirus ne saura pas s'adapter facilement pour devenir insensible aux traitements.
Au niveau moléculaire, la liaison des DFSA avec la protéine virale induit la formation d'un nouveau composé qui va emprisonner l'enzyme, un peu comme une clé cassée dans une serrure. Pendant une centaine d'heures, elle est réduite au silence et l'infection est alors sous contrôle.
Les DFSA pour remplacer le Tamiflu ?
Les médicaments ont été testés sur des souris avec plusieurs souches et leur efficacité s'est révélée aussi importante que le TamifluTamiflu et Relenza. À des doses normalement mortelles, tous les rongeursrongeurs traités ont survécu. Des cellules humaines en culture ont montré leur bonne santé lorsqu'elles bénéficiaient des DFSA. Sur le papier donc, cela fonctionne.
Mais nombreuses sont les molécules efficaces en laboratoire qui ne deviennent jamais des médicaments. Les investigations seront poursuivies pour s'assurer de l'utilité de ces composés dans le traitement de la grippe, et surtout pour vérifier qu'ils limitent effectivement les problèmes de résistancerésistance. Les débuts sont prometteurs, mais seul le résultat final compte. Verdict maintenant dans quelques années si tout se passe bien...