au sommaire
Le débat est relancé. À l'heure où l'on commence à intégrer les cellules souches embryonnaires (CSECSE) dans les protocolesprotocoles des essais cliniques, la question se pose pour l'intégration des cellules souches pluripotentes induites (CSPi) dans des thérapies humaines. Sont-elles sans danger ? Les avis divergent.
En 2011, des scientifiques de l'université de Californie à San Diego (UCSD) précisaient dans Nature que les CSPi, ramenées à l'état natif depuis des cellules différenciées, étaient rejetées par le système immunitaire une fois réinjectées dans l'hôte. Ce qui n'est pas le cas des CSE, qui donnaient naissance à des tumeurs appelées tératomes et présentant différents types cellulaires. Leur développement était le signe de l'acceptation de la transplantation par le receveur. En revanche, pour les CSPi, les tératomes ne se formaient pas, car les cellules étaient détruites par le système immunitaire. Conclusion de l'observation : les CSPi provoqueraient des réactions immunitaires, et seraient donc immunogènes.
Les CSPi aussi fiables que les CSE
Ces résultats sont aujourd'hui contestés par des biologistes japonais du National Institute of Radiological Sciences (Chiba, Japon) dirigés par Masumi Abe. Ils viennent de démontrer, toujours dans la revue Nature, que les CSPi ne déclenchaient pas plus l'immunitéimmunité que leurs homologues extraites depuis les premiers stades embryonnaires.
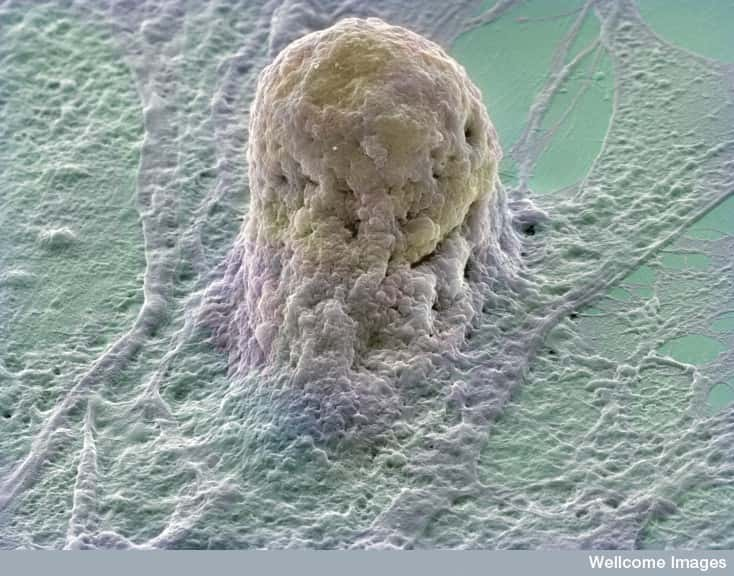
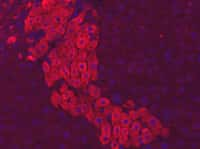
Les cellules souches embryonnaires, comme celle représentée à l'image, commencent à intégrer les protocoles des essais cliniques. Dans un futur proche, elles soigneront peut-être des êtres humains. Les CSPi leur emboîteront-elles le pas ? © Annie Cavanagh, Wellcome Images, Flickr, cc by nc nd 2.0
Dans cette nouvelle expérience, les auteurs ont transplanté des cellules de peau et de moelle osseusemoelle osseuse issues de CSPi et de CSE afin de comparer les risques de rejet. Deux mois après l'opération, les taux de réussite étaient comparables. Dans les deux cas, la réponse immunitaire est indétectable.
Des conclusions qui rassurent et qui font écho à une troisième étude, également publiée dans Nature, fin 2012. Elle tendait à montrer que les manipulations génétiquesgénétiques nécessaires à la dédifférenciation des cellules en CSPi induisaient moins de mutations de l'ADNADN que prévu. La plupart des anomaliesanomalies génétiques étaient en réalité présentes dans les cellules originelles.
Le protocole de Masumi Abe avec des cellules souches fait débat
Pour autant, le débat sur l'innocuité de ces cellules souches n'est pas clos. Yang Xu, l'un des auteurs de l'étude critique de 2011, a fait part de ses doutes sur la pertinence du protocole utilisé par ses confrères japonais. Si l'on devait utiliser les CSPi dans des cliniques, elles seraient mises en culture puis transformées in vitroin vitro en cellules de la peau, de la moelle osseuse ou d'un autre tissu.
Or, Masumi Abe et ses collaborateurs ont eu recours à un autre protocole, utilisé pour s'assurer que la reprogrammation était effective. Au lieu de mettre leurs cellules souches en culture, elles ont été placées dans des embryonsembryons de souris génétiquement identiques. Ces dernières deviennent alors chimériqueschimériques, c'est-à-dire qu'elles possèdent à la fois leur patrimoine génétique et celui des cellules implantées.
Une fois adultes, les souris ont reçu par transplantationtransplantation les cellules de peau et de moelle osseuse issues des CSPi. Dans ce cas, aucune différence à propos de l'immunogénicitéimmunogénicité n'a été observée par rapport aux CSE.
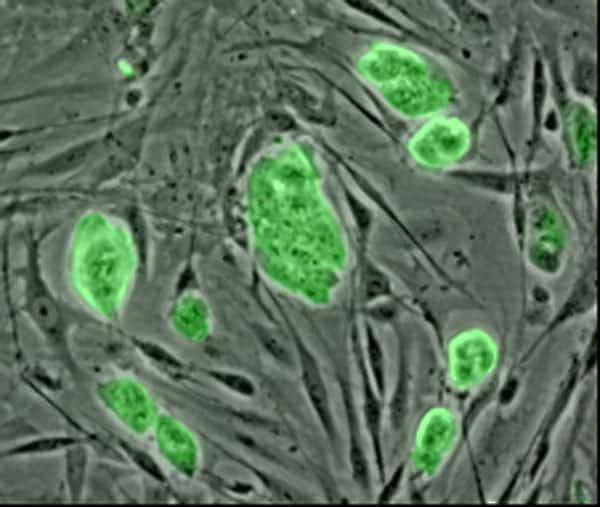
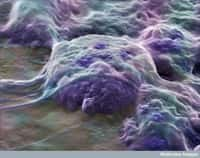
Les cellules souches embryonnaires (à l’image) ont d'abord été découvertes chez les souris en 1981, avant d'être mises en évidence chez l'Homme en 1998. Les cellules souches pluripotentes induites, elles, ont été découvertes en 2007. © National Science Foundation, DP
Des cellules souches qui stimulent le système immunitaire
Cependant, Yang Xu voit un biais dans l'étude de Masume Abe. Il estime que les cellules induisant un rejet du système immunitaire ont pu être détruites durant le développement des souris. Dans cette hypothèse, il ne resterait que celles tolérées par les défenses des organismes.
D'autres scientifiques, comme Paul Fairchild (de l'Oxford Stem Cell Institute), partagent son avis. Il considère que les gènesgènes Zg16 et Hormad1, stimulés lors de la dédifférenciation cellulaire (passage de la cellule différenciée à la CSPi), favorisent la réponse du système immunitaire. En revanche, la transplantation précoce permet à l'organisme en développement d'éteindre ces gènes et donc de diminuer l'immunogénicité.
Paul Knoepfler, rattaché à l'université de Californie à Davis, fait part d'un point de vue mitigé, dans les colonnes de la revue The Scientist. Pour lui, la découverte est très intéressante, mais il modère ses propos en précisant qu'effectivement, des cellules en culture ont tendance à présenter un profil moins bien toléré par les défenses immunitaires.
Vif débat sur les CSPi
Il reste encore à éclaircir l'éternel problème qui se pose lorsqu'on réalise des essais chez l'animal : est-ce extrapolable à l'Homme ? Il est encore un peu tôt pour le dire. Mais Masumi Abe défend ses positions et l'intérêt de l'usage de ces cellules dans des thérapies de médecine régénérative.
Il répond à Yang Xu, précisant que son étude souffre également d'un biais : ce travail s'intéresse à l'évolution des tératomes, donc de tumeurs qui, de ce fait, sont indésirables pour un organisme et tendent à stimuler le système immunitaire. Masumi Abe n'y voit donc rien d'inquiétant.
Le débat est loin d'être clos : les avis divergent. Ils devront néanmoins converger un jour si l'on compte tester les CSPi chez l'Homme. Il serait dommage de ne pas le faire, car leur potentiel thérapeutique est immense...