Le cancer du sein est le plus fréquent chez la femme. En France, en 2011, 53.000 nouveaux cas ont été détectés et 11.500 personnes en sont mortes. © Annie Cavanagh, Wellcome Images, Flickr, cc by nc nd 2.0
- Tout savoir sur le cancer du sein avec notre dossier
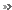
Des chercheurs du CEA, de l'Inserm, du CNRS et des universitaires ont mis en évidence le rôle déterminant de la protéine CK2 dans la plasticitéplasticité cellulaire épithéliale, notamment dans le cas de pathologies cancéreuses. En effet, une altération de l'activité de cette protéine implique des variations importantes dans la transformation des cellules épithéliales en cellules cancéreuses plus mobilesmobiles, à l'origine des métastases.
Ces travaux, publiés en ligne le 7 mai par la revue Oncogene, révèlent donc un nouveau rôle pour cette protéine-kinase multifonctionnelle dans la progression de tumeurs mammaires chez la femme.
Les dangers de l’EMT
Dans leur majorité, les tissus qui composent les organes du corps humain sont constitués d'un ensemble de cellules épithéliales cohésives et polarisées reposant sur une membrane. Au cours du développement du cancer, certaines cellules épithéliales présentes dans la tumeur peuvent réactiver un mécanisme cellulaire appelé Epithelial-to-Mesenchymal Transition (EMT).
Ce processus est responsable de l'évolution des cellules d'un état épithélial vers un état mésenchymateux caractérisé par une mobilité cellulaire accrue et une résistancerésistance à certains anticancéreuxanticancéreux. Dans le cas d'une tumeur primaire, cette évolution peut conduire à la dispersion des cellules cancéreuses dans le corps et à l'apparition de métastases. Cette plasticité cellulaire est régulée par des voies de signalisation et des facteurs de transcription tels que le facteur Snail1.
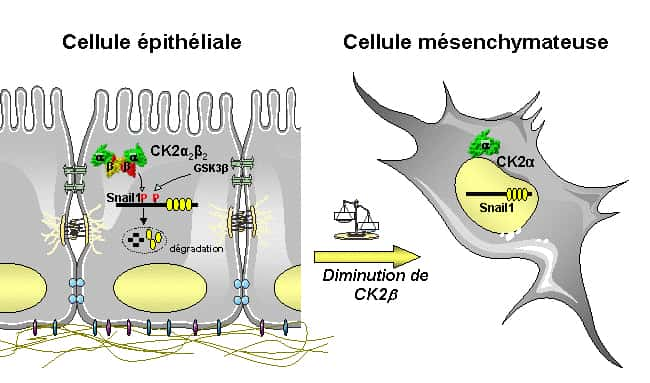
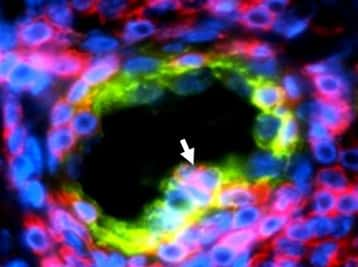
Le facteur Snail1, présent sous sa forme phosphorylée, est dégradé en permanence dans les cellules épithéliales. Lorsque CK2 est inactivée à cause d'une altération, elle n'assure plus son rôle de phosphorylation. L'EMT s'active, la transformation en cellule mésenchymateuse se produit. © A. Deshiere, O. Filhol-Cochet
Depuis quelques années, l'équipe dirigée par Claude Cochet étudie l'implication de la protéine kinase CK2 dans les pathologies cancéreuses. Cette enzymeenzyme est un complexe formé de l'association d'une sous-unitésous-unité catalytique (CK2α) et d'une sous-unité régulatrice (CK2β).
CK2 altérée favorise la dispersion cellulaire
Cette équipe a récemment mis en évidence qu'une dérégulation de l'activité de cette protéine, observée dans certains cancers du sein, est associée à l'expression de marqueurs de l'EMT. Plus précisément, les chercheurs ont montré qu'une diminution, dans des cellules épithéliales mammaires en culture, de l'expression de la sous-unité régulatrice CK2β, conduit à des changements caractéristiques de l'EMT : en perdant leur cohésion, certaines de ces cellules cancéreuses deviennent mobiles et migrent dans l'organisme.
Des analyses cellulaires, biochimiques et transcriptomiques ont permis d'identifier Snail1 comme étant une cible de cette protéine kinase. Par conséquent, en induisant la phosphorylationphosphorylation (ajout d'un groupement phosphatephosphate, qui active la moléculemolécule) de Snail1, l'activité de la protéine kinase CK2 est nécessaire pour empêcher l'activation de l'EMT, et ainsi diminuer le risque de développement de métastases. Cette kinase est donc essentielle au maintien de l'état épithélial des cellules. « Ces résultats illustrent l'importance de CK2β dans le contrôle de la plasticité cellulaire, précise Odile Filhol. Ils révèlent un mécanisme qui supprime l'EMT et maintient l'intégritéintégrité des cellules épithéliales ».
Cette étude révèle que la protéine-kinase CK2 est un régulateur clé de l'homéostasiehoméostasie des cellules épithéliales. Grâce à ses propriétés de marqueur dans plusieurs types de cancerscancers et à ses qualités en tant que cible thérapeutique, CK2 a acquis le statut d'un biomarqueur théranostique (thérapeutique et diagnostique) pertinent.