au sommaire
La bactérie Mycobacterium tuberculosis a fondamentalement besoin de l'acide aspartique environnant pour en récupérer l'azote. Et si on l'en empêchait ? © Sanofi Pasteur, Flickr, cc by nc nd 2.0
La tuberculose est une maladie infectieuse qui touche généralement les poumons. Tuant plus de 1,5 million de personnes chaque année à travers le monde, elle est provoquée par une bactérie appelée Mycobacterium tuberculosisMycobacterium tuberculosis. Contre ce bacille, il existe un vaccin, le BCG, dont l'efficacité est trop variable, ainsi que des traitements antibiotiques. Cependant, les médecins sont de plus en plus souvent confrontés à des souches résistantes à plusieurs des antibiotiques disponibles. D'où la nécessité de développer de nouvelles stratégies thérapeutiques et préventives.
Les chercheurs de l'Institut de pharmacologie et de biologie structurale (université Toulouse III) qui ont coordonné ces travaux se sont intéressés aux mécanismes permettant à M. tuberculosis de s'approvisionner en azoteazote, élément essentiel à la synthèse d'un grand nombre de biomolécules, protéinesprotéines, acides nucléiquesacides nucléiques, et vitaminesvitamines par exemple. Ils ont ainsi étudié un transporteur d'acides aminésacides aminés appelé AnsP1. Ils ont montré dans Nature Chemical Biology que cette protéine transmembranaire est chargée de capturer de l'aspartateaspartate, un acide aminé, pour l'introduire dans la bactérie. En effet, un mutant du bacille inactivé génétiquement pour ce transporteur AnsP1 s'est révélé incapable de croître dans un milieu contenant l'aspartate comme unique source d'azote.
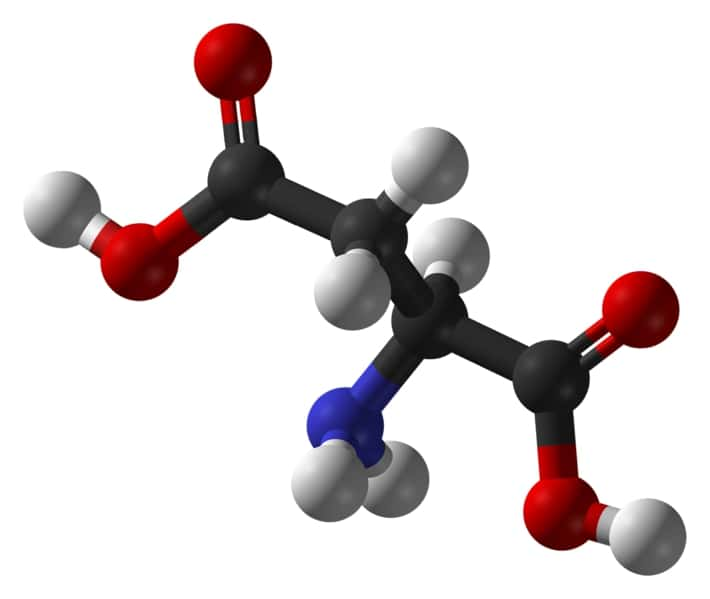
L'aspartate est une molécule assez simple, avec un atome d'azote (en bleu). C'est ce que convoitent les germes à l'origine de la tuberculose pour se développer ! © Jynto et Ben Mills, Wikipédia, DP
AnsP1, cible de futurs antibiotiques contre la tuberculose
Dans un second temps, les chercheurs se sont demandé si l'aspartate constituait réellement une importante source d'azote pour le bacille. Pour cela, ils ont employé une technique qui permet de cartographier l'ensemble des métabolitesmétabolites présents dans une cellule. Les chercheurs ont nourri des bactéries avec de l'aspartate contenant un isotopeisotope lourd de l'azote. Ils ont ainsi prouvé qu'effectivement M. tuberculosis assimilait l'azote issu de l'aspartate, qui se retrouvait ensuite dans de nombreuses moléculesmolécules synthétisées par le micro-organisme.
Les chercheurs ont révélé, grâce à une technique d'imagerie des petites molécules, que lorsque des macrophages (cellules du système immunitairesystème immunitaire présentes en grande quantité dans les voies pulmonaires) infectés par le bacille étaient mis en présence d'aspartate lourd, celui-ci se retrouvait finalement à l'intérieur du pathogènepathogène. Autrement dit, AnsP1 permet au bacille de capturer l'azote de sa cellule hôte. Lors d'expériences in vivoin vivo, les chercheurs ont infecté des souris avec un bacille dont AnsP1 était inactivé. De façon surprenante, cette souche s'est révélée fortement atténuée : elle se multipliait plus lentement et endommageait beaucoup moins les poumons des souris que les souches normales. Ceci révèle le rôle jusqu'ici insoupçonné de ce transporteur d'aspartate dans la virulence de la mycobactériemycobactérie.
Le transporteur AnsP1 et les autres molécules impliquées dans le métabolismemétabolisme de l'aspartate pourraient alors constituer des cibles de choix pour de nouveaux antibiotiques. Par ailleurs, cette souche mutante dont AnsP1 a été inactivée pourrait être un bon candidat pour la conception de nouveaux vaccins, capables de fournir une protection plus efficace et plus longue que le BCGBCG.