Une vaste étude met en évidence les différences d’expression génétique entre les sexes, ce qui pourrait expliquer par exemple pourquoi les hommes et les femmes réagissent différemment aux médicaments ou sont plus ou moins sensibles à certaines maladies. Un nouveau pas vers une médecine personnalisée selon le sexe ?
au sommaire
- Épigénétique : l’expression du gène aussi importante que le gène lui-même
- Médicament, poids de naissance et calvitie
- Les variations entre individus, plus significatives que celles entre les sexes
- La première carte de l'épigénome humain révèle les secrets de l'ADN
- Un ADN « poubelle », clé de l'activité moléculaire
- À lire aussi
C'est le résultat d'un travail titanesque qui vient de paraître dans la revue Science du 10 septembre. L'étude, mettant en valeur les différences d'expression génétique entre les sexes, fait partie d'un ensemble de 15 articles publiés par le consortium GTEx (Genotype-Tissue Expression), aboutissement de dix années d'efforts, financé par les National Institutes of Health (NIH). Ce projet GTEx vise à créer une ressource publique complète pour étudier l'expression et la régulation des gènes dans chaque tissu.
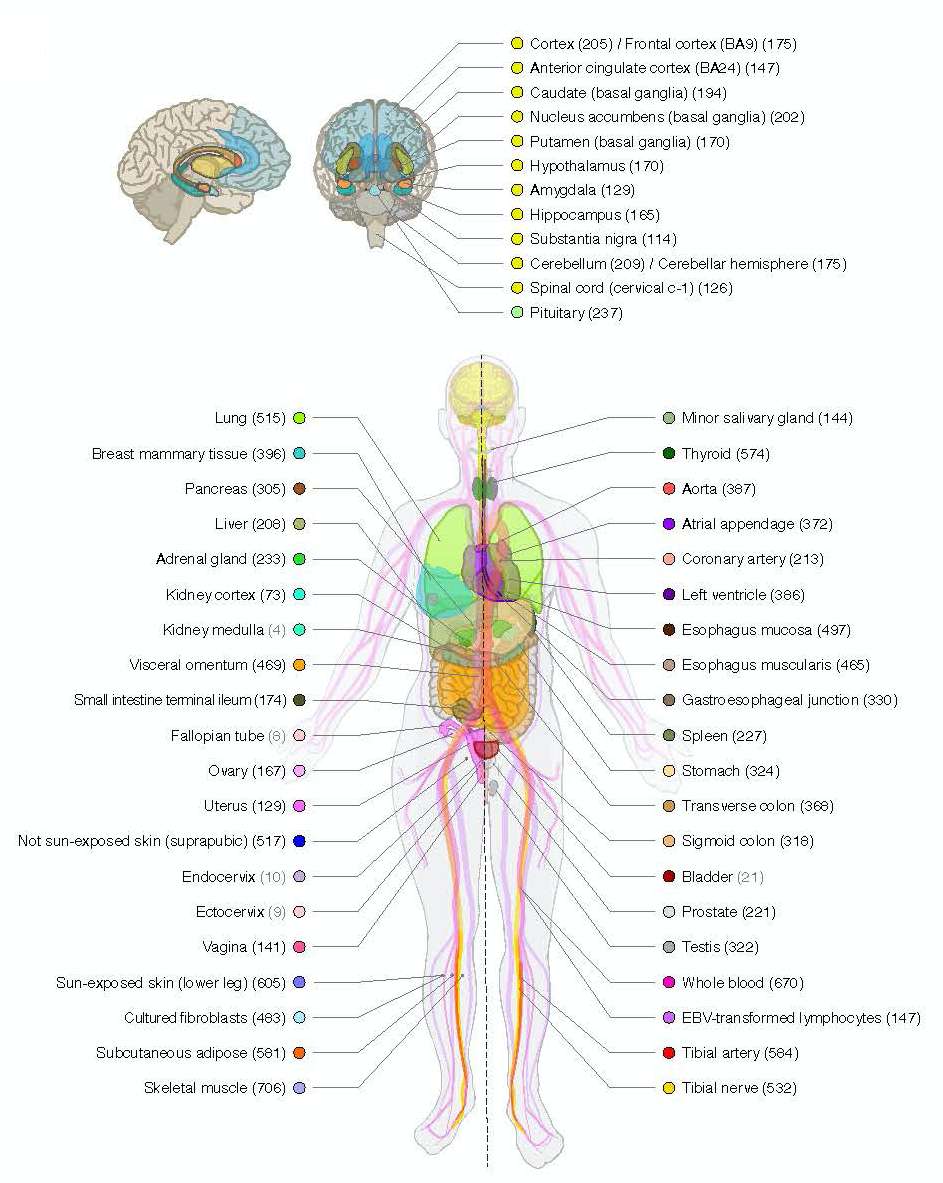
Épigénétique : l’expression du gène aussi importante que le gène lui-même
Quand on pense génétique, on raisonne souvent selon l'absence ou la présence de tel ou tel gène. Or, les différences de phénotype et de nombreux facteurs biologiques (poids, maladies, vieillissement, taux de sucre dans le sang...) dépendent aussi étroitement de la façon dont les gènes sont utilisés par la cellule (épigénétique). Certains gènes restent ainsi souvent en grande partie inactivés. Ces variations d'expression sont appelées « transcriptome » (voir encadré).
Le saviez-vous ?
Le transcriptome, qu’est-ce que c’est ? Un gène contient un code ADN pouvant être lu et transcrit en protéines fonctionnelles. Il génère pour cela un brin d’ARN à partir du code ADN, qui sert de guide pour fabriquer la protéine. Plus le gène est actif, plus il produit d’ARN et donc de protéines. C’est la quantité et la qualité de l'ARN que l’on appelle transcriptome et qui est utilisé pour mesurer l’activité des gènes.
Ainsi, les différences entre les sexes, communément attribuées aux hormoneshormones et aux chromosomes sexuelschromosomes sexuels, seraient en grande partie dues à ce fameux transcriptome. 37 % des gènes humains ont une expression différenciée selon que l'on est un homme ou une femme, rapporte l'étude de Science. Dans les 44 types de tissus analysés, 1,3 à 12,9 % des gènes sont activés différemment. Si ces derniers sont majoritairement situés sur le chromosome X, ils ne représentent que 4 % des gènes s'exprimant différemment, le reste étant réparti sur les chromosomes ordinaires. La majorité des effets découverts sont observés dans le tissu mammaire, suivi par le muscle, la peau et le tissu adipeuxtissu adipeux.
Médicament, poids de naissance et calvitie
Les scientifiques ont découvert 58 liens inédits entre l'expression génétique et des caractéristiques des individus, comme la pressionpression sanguine, le taux de cholestérolcholestérol ou le risque de cancer du seincancer du sein. Le gène CYP450, qui influe sur l'assimilation des médicaments humains dans le foiefoie, s'exprime ainsi de manière différenciée selon le sexe dans de nombreux tissus. Cela pourrait expliquer pourquoi certains médicaments sont plus efficaces chez l'homme que la femme (ou vice versa). Chez les femmes, la régulation génétique du CCDC88 est fortement associée à la progression du cancer du sein, et l'activité du gène HKDC1 est corrélée au poids de naissance (en modifiant le métabolismemétabolisme du glucoseglucose dans le foie de la femme enceinte). Chez les hommes, la régulation génétique du DPYSL4 est associée au pourcentage de graisse corporelle et celle du CLDN7 au poids de naissance. Les chercheurs ont également identifié un lien entre l'expression du gène C9orf66 et la calvitiecalvitie masculine.
Les variations entre individus, plus significatives que celles entre les sexes
Ces 37 % de variations peuvent sembler importantes, mais en réalité leurs effets sont relativement limités, tempèrent les auteurs. Ces différences sont notamment masquées par les variations inter-individuelles, bien plus significatives. Les chercheurs ont d'ailleurs essayé de prédire le sexe d'une personne en partant de son transcriptome et ne sont pas parvenus à un résultat probant. Autre limite : les échantillons sont majoritairement issus d'hommes (67,1 %) et de type caucasien (85 %). Les sujets sont aussi majoritairement âgés de plus de 50 ans, ce qui signifie que l'expression de leur génomegénome a pu être influencée par des facteurs environnementaux. Il s'agit donc d'un aperçu instantané pas forcément représentatif des différences tout au long de la vie.
La première carte de l'épigénome humain révèle les secrets de l'ADN
Article de l'AFP publié le 21/02/2015
L'épigénome humain correspond à l'ensemble des modifications qui interviennent dans la régulation des gènes. Car, à la différence du patrimoine génétique, l'épigénome est variable. Il joue d'ailleurs un rôle important dans l'apparition et le développement des maladies. Un groupe de scientifiques a publié mercredi 18 février les données les plus complètes disponibles à ce jour sur ces modifications.
Présentées comme la première carte exhaustive de l'épigénome d'un grand nombre de cellules humaines, les données figurent dans une vingtaine d'études publiées simultanément dans la revue scientifique Nature par des chercheurs participant au vaste programme Epigenomics. Celui-ci a été lancé en 2006 par les instituts nationaux de santé américains.
Après avoir séquencé le génome de l'Homme, qui reste globalement identique tout au long de la vie, les scientifiques ont voulu comprendre comment l'activation des gènes pouvait être influencée par notre régime alimentaire ou notre environnement.
Le mécanisme passe par l'épigénétique : certaines régions de l'ADNADN sont en effet prises pour cibles, notamment par le biais d'un processus appelé « méthylationméthylation » qui aboutit à diminuer voire à éteindre l'expression d'un gène. De nombreuses incertitudes subsistent toutefois autour des processus impliqués mais les chercheurs sont de plus en plus persuadés qu'ils jouent un rôle important dans des pathologiespathologies comme le cancer, l'autismeautisme, la maladie d'Alzheimer ou dans le vieillissement.
Le chimiste et biologiste Joël de Rosnay explique les principes de l'épigénétique. © Mici Sans Frontières, YouTube
Un ADN « poubelle », clé de l'activité moléculaire
Les études publiées mercredi 18 février ont notamment décrit l'épigénome de 111 types de cellules cardiaques, musculaires, hépatiques, dermatologiques et fœtales. Les gènes représentent à peine 1,5 % du génome humain. Le reste a longtemps été considéré comme de l'ADN non codant. Des découvertes récentes ont toutefois permis de montrer que cet ADN, hâtivement qualifié d'« ADN poubelle », pouvait en réalité jouer un rôle essentiel dans la régulation de l'activité des gènes.
« Il s'agit d'un progrès majeur dans les efforts en cours pour comprendre comment les trois milliards de lettres figurant dans le livre de l'ADN d'un individu peuvent entraîner des activités moléculaires très diverses », relève Francis Collins, chef de l'Institut national de santé américain (NIH) qui participe au programme Epigenomics.
Des chercheurs de la Harvard Medical School du Massachusetts, aux États-Unis, ont pour leur part montré que la signature génétique unique d'une cellule cancéreuse pouvait être utilisée pour identifier la cellule d'origine d'une tumeurtumeur. D'autres chercheurs ont exploré la piste épigénétique dans la maladie d'Alzheimermaladie d'Alzheimer chez des souris tandis que des chercheurs de l'Imperial College de Londres, au Royaume-Uni, ont identifié 34 gènes jouant un rôle dans l'asthme et dans les allergiesallergies.
« Il n'y a pas que le code génétiquecode génétique qui puisse influencer la maladie », souligne William Cockson, professeur à l'Imperial College, estimant que la manière dont les gènes sont lus pourrait jouer un rôle encore bien plus important.