Les résultats offerts par le vaccin Oxford-AstraZeneca contre le coronavirus sont encourageants, mais ils viennent avec une ambiguïté. Les données semblent en effet indiquer des taux d’efficacité contradictoires en fonction des doses injectées.
au sommaire
Parmi les vaccins candidats dans la lutte contre le coronavirus, celui issu de la collaboration entre l'université d'Oxford et le groupe AstraZenecaAstraZeneca se démarque avec des résultats encourageants. Récemment, un communiqué de presse annonçait un taux d'efficacité de 70 %. Néanmoins, il semblerait que les données soient un peu plus complexes que ce chiffre ne l'avait laissé paraître. Tout serait en effet question de dosagedosage, et ce qu'ont constaté les chercheurs n'a rien d'intuitif...
Des résultats contre-intuitifs
Les 70 % d'efficacité seraient en effet la moyenne de deux données : le taux d'efficacité pour l'injection d'une demi-dose du vaccin, et pour l'injection de la dose entière, pour laquelle est normalement conçu celui-ci afin de garantir une protection optimale. Mais une surprise attendait les spécialistes : le vaccin était plus efficace lorsque l'injection demeurait incomplète ! En effet, avec une demi-dose, l'efficacité constatée serait de 90 %, contre seulement 62 % de protection après l'injection de la seconde moitié, un mois après.
Erreur humaine ou phénomène biologique ? Le jury délibère encore. « Nous allons mener une enquête détaillée pour comprendre exactement pourquoi nous obtenons une meilleure efficacité avec une demi-dose », a déclaré Sarah Gilbert, professeur de vaccinologie et directrice de l'équipe à l'université d'Oxford. Son intuition est qu'une demi-dose « imite » mieux ce qu'il se passe lorsqu'une personne est infectée. « Il se pourrait que donner une petite quantité de vaccin pour commencer et suivre avec une plus grande quantité soit une meilleure façon de mettre le système immunitaire en action, et de nous donner la réponse immunitaire la plus forte et la plus efficace. »
Prochaine étape : la balle aux États-Unis
Les résultats n'ont pas manqué d'intriguer les scientifiques qui s'étaient attendus à une bien meilleure protection avec deux injections. Il est malheureusement trop tard dans les phases de tests pour modifier le protocoleprotocole au Royaume-Uni, mais les essais aux États-Unis pourraient bien être adaptés pour qu'une seule demi-dose soit injectée. Les différentes méthodologie et moyens de mesure employés rendent néanmoins toute comparaison complexe et placent les chercheurs face à un dilemme.
Le vaccin Oxford-AstraZeneca s'annonce moins cher et plus facile à stocker que les solutions produites par Moderna ou Pfizer, et le groupe a annoncé son intention de produire près de 3 milliards de doses l'année prochaine. Cependant, faudra-tt-il juger de l'efficacité du vaccin face à ses concurrents sur la base d'une demi-dose ou d'une dose entière ? Le débat demeure pour l'instant ouvert.
Coronavirus : le vaccin d'AstraZeneca montre des résultats encourageants chez les plus âgés
Article de Futura avec l'AFP-Relaxnews, publié le 19 novembre 2020
Moins avancé que ceux de PfizerPfizer-BioNTech et Moderna, le candidat-vaccin du groupe pharmaceutique britannique AstraZeneca et de l'université d'Oxford donne des résultats encourageants. Les données publiées montrent qu'il provoque une réponse immunitaire chez les personnes âgées, un groupe des plus vulnérables face à la Covid-19, identique à celle des plus jeunes.
Le vaccin contre le Covid-19 développé par AstraZeneca et l'université d'Oxford provoque une réponse immunitaire chez les personnes les plus âgées, particulièrement à risques, selon des résultats publiés jeudi qui confirment des annonces déjà faites en octobre. Ces résultats intermédiaires portent toutefois sur un stade de développement moins avancé, dit « de phase 2 », que ceux qui ont fait l'objet d'annonces spectaculaires ces dix derniers jours par les fabricants BioNTech-Pfizer et Moderna. Ces derniers ont tous deux assuré que leur vaccin est efficace à 95 % et 94,5 % en se basant sur les résultats du dernier stade des essais cliniques (la phase 3). Ces annonces n'ont pas encore fait l'objet d'une publication détaillée dans une revue scientifique.
Les résultats de la phase 2 du projet AstraZeneca et de l'université d'Oxford sont publiés jeudi par la revue médicale The Lancet. Principal enseignement : ce vaccin provoque chez les sujets les plus âgés (plus de 56 ans) une réponse immunitaire identique à celle qu'il déclenche chez les plus jeunes (18 à 55 ans). Cette observation est importante, car comme le rappelle The Lancet, « les adultes les plus âgés ont un risque décuplé de faire une forme grave de Covid-19, et il est donc essentiel qu'un vaccin destiné à lutter contre cette maladie soit efficace dans ce groupe de population ».
Un système immunitaire qui s'affaiblit avec l'âge
« La réponse immunitaire déclenchée par les vaccins est souvent moins forte chez les adultes les plus âgés car le système immunitaire s'affaiblit graduellement avec le temps », a expliqué le Pr Andrew Pollard, l'un des responsables de l'essai pour l'Université d'Oxford. Les chercheurs notent toutefois une limite à leur étude. La moyenne d'âge dans le groupe des participants les plus vieux était de 73 à 74 ans et peu d'entre eux avaient des problèmes de santé. « Il se pourrait donc qu'ils ne soient pas représentatifs de l'ensemble de la population âgée, dont les gens qui vivent dans des établissements spécialisés ou les plus de 80 ans », note The Lancet.
Ces résultats devront donc être « confirmés au sein d'un échantillon plus large de volontaires, incluant des personnes âgées souffrant de problèmes de santé » : c'est le but des essais de phase 3 actuellement en cours pour ce vaccin, qui portent sur des milliers de personnes.
La phase 2, elle, concernait 560 participants (160 âgés de 18 à 55 ans, 160 de 56 à 59 ans et 240 de plus de 70 ans). Ils avaient été répartis dans plusieurs groupes où on leur a administré soit le vaccin soit un autre produit, pour pouvoir comparer et évaluer l'efficacité de celui-ci.
De son côté, l'alliance Pfizer-BioNTech a assuré mercredi que son propre vaccin était efficace chez les plus de 65 ans selon les résultats de phase 3, ce qui doit encore être confirmé par leur publication.
Coronavirus : les études cliniques reprennent pour le vaccin d'Oxford
Article de Julie KernJulie Kern, publié le 29 octobre 2020
La FDA a autorisé la reprise des études cliniquesétudes cliniques du vaccin d'Oxford aux États-Unis, suspendu depuis septembre 2020. Le vaccin d'AstraZeneca en collaboration avec l'université d'Oxford est à nouveau dans la course au traitement contre la Covid-19. L'entreprise pharmaceutique espère présenter les derniers résultats de son candidat d'ici la fin de l'année.
Après qu'un participant est tombé malade, les études cliniques du « vaccin d'Oxford », un candidat vaccin destiné à lutter contre le coronavirus, ont dû être suspendues en septembre dernier. Dans un communiqué de presse, la société pharmaceutique a annoncé que la FDA (Food and Drug AdministrationFood and Drug Administration) a autorisé la reprise des essais cliniques du vaccin aux États-Unis, les considérant comme sûrs. Ces derniers avaient déjà repris au Royaume-Uni, au Brésil, en Afrique du Sud et au Japon en accord avec les autorités de santé de chaque pays.
Pascal Soriot, le P.-D.G. d'AstraZeneca, a déclaré que « la reprise des essais cliniques dans le monde entier est une excellente nouvelle car elle nous permet de poursuivre nos efforts pour développer ce vaccin afin de contribuer à vaincre cette terrible pandémie. Nous devons être rassurés par le soin apporté par les régulateurs indépendants pour protéger le public et s'assurer que le vaccin est sûr avant d'être approuvé pour son utilisation ».
Le vaccin d'Oxford approuvé pour les fêtes de fin d'année ?
Issu de la collaboration de l'université d'Oxford et d'AstraZeneca, le vaccin AZD1222, appelé autrefois ChadOx1, subit les dernières phases de test (phase III) avant sa commercialisation. AstraZeneca annonce que les résultats finaux sont attendus avant la fin de l'année 2020 et seront publiés dans des revues scientifiques à comité de lecture. Il fait partie des dix vaccins à l'étude les plus avancés. Selon les résultats de la phase III, il pourrait être approuvé par les autorités de santé d'ici décembre 2020. La Chine a déjà approuvé quatre candidats vaccins contre la Covid-19 et la Russie, un seul après études cliniques.
Coronavirus : le vaccin d’Oxford initie une réponse immunitaire selon les premiers résultats
Article publié le 21 juillet 2020 par Julie Kern
La course au vaccin contre le coronavirus bat toujours son plein. Parmi les candidats en lice, le vaccin d'Oxford en collaboration avec AstraZenaca vient de publier les résultats de la première phase des essais cliniques pour son vaccin ChAdOx1. Ils sont positifs mais la course sera longue et ligne d'arrivée est encore loin.
Malgré l'arrivée des beaux jours, malgré le confinement, le coronavirus se propage toujours d'humain à humain. Alors que le port du masque est devenu obligatoire dans les lieux publics clos en France pour limiter le regain de l'épidémieépidémie, des pays comme l'Inde ou le Brésil sont toujours pris dans le tumulte de la première vaguevague de population infectée. Du côté de la recherche scientifique, les laboratoires et les expériences tournent à plein régime. Mais, comme Rome ne s'est pas faite en un jour, concevoir un vaccin ou un traitement efficace et sûr demande du temps.
Le 20 juillet 2020, les résultats des essais cliniques de phase 1/2 du vaccin conçu à l'Institut Jenner de l'Université d'Oxford en Angleterre, en partenariat avec AstraZeneca, ont été publiés dans la revue The Lancet. Ces derniers offrent un premier aperçu positif quant à l'immunitéimmunité induite et sa toxicitétoxicité.
Un adénovirus de singe et la protéine S du coronavirus
Le vaccin d'Oxford, le ChAdOx1 (pour Chimpanzee Adenovirus Oxford 1), est composé d'un adénorivus de chimpanzéchimpanzé incapable de se répliquer qui a été modifié génétiquement. Les scientifiques ont introduit dans son génomegénome la partie codante pour la protéineprotéine S du SARS-CoV-2SARS-CoV-2 grâce à un plasmideplasmide. Son immunogénicité a été confirmée il y a seulement quelques mois, fin mai 2020, sur des macaques rhésusmacaques rhésus.
Au regard des résultats encourageants, les chercheurs ont initié une étude clinique pour ChAdOx1, dont les premiers résultats sont désormais disponibles et qui a été menée dans cinq hôpitaux différents à travers toute l'Angleterre. Il s'agit d'une étude randomiséeétude randomisée, c'est-à-dire que les volontaires ont été placés dans les différents groupes au hasard, et en simple-aveugle, les médecins connaissaient le traitement administré mais pas les volontaires. Les résultats du groupe test, qui a reçu une injection de ChAdOx1, sont comparés à un groupe contrôle qui s'est vu administrer un autre vaccin, le MenACWY (destiné à lutter contre les méningocoquesméningocoques), selon le même protocole.
Des réactions lors de la vaccination, mais pas de toxicité
Au total, 1.077 volontaires ont participé à cet essai clinique (543 dans le groupe test et 534 dans le groupe contrôle), âgés de 18 à 65 ans et avec un bon état de santé général. Les individus du groupe test ont reçu une dose de 5.1010 particules virales par voie intramusculaire dans le muscle deltoïde. Le groupe contrôle une injection standard de 0,5 mL de MenACWY, aussi dans le deltoïde.
À partir de cette injection initiale, les scientifiques ont réalisé des tests immunologiques selon un calendrier précis. Ils ont également réalisé un suivi des effets secondaires induits par la vaccinationvaccination.
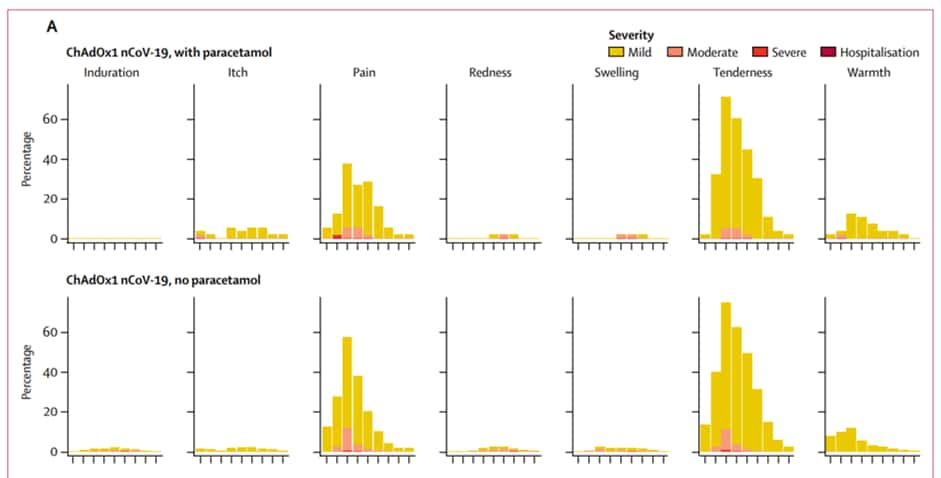
Regardons tout d'abord les effets secondaires de la première injection pour les deux groupes. Premier constat, la plupart des volontaires affirment souffrir de symptômessymptômes légers à modérés. Parmi les effets secondaires localisés au site de l'injection, la douleurdouleur est la plus commune. Suivie d'une sensibilité ou d'un inconfort lorsqu'on touche la zone. Ces désagréments interviennent entre le premier et deuxième jour suivant la vaccination puis disparaissent progressivement en une semaine.
Les volontaires ont également rapporté des effets secondaires systémiques comme de la fatigue, des maux de tête, des douleurs musculaires et des malaises. Ces symptômes sont les plus forts au premier jour suivant la vaccination avant de s'atténuer dans les jours suivants.
Bien qu'il n'y ait aucun effet secondaire sévère ou nécessitant une hospitalisation, deux hôpitaux impliqués dans l'essai clinique ont demandé à utiliser du paracétamolparacétamol pour les atténuer. Comparé au groupe contrôle, les symptômes ont été ressenti par plus de participants et de façon plus intense.
La primo-injection provoque donc une réaction locale et systémique de l'organisme, parfois intense et contraignante, mais qu'en est-il de la réponse immunitaire ?
Des anticorps produits et des lymphocytes activés
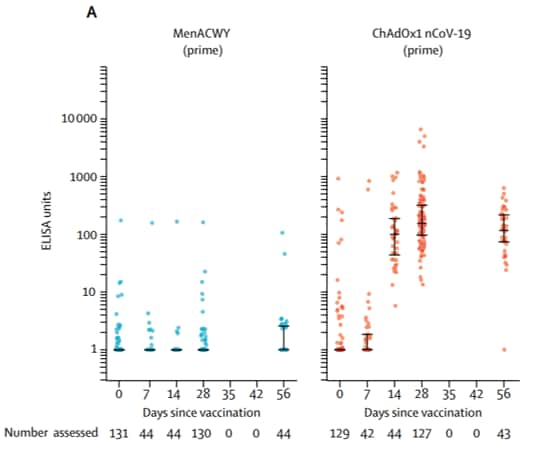
Les chercheurs ont réalisé des tests immunologiques (de type Elisa) à la recherche des anticorps de type IgG dirigés contre la protéine S du SARS-CoV-2, le jour de la vaccination, puis à J7, 14, 28, et 56.
Le pic d'anticorpsanticorps spécifiques du SARS-CoV-2 intervient au 28e jour après la première dose et reste à peu près stable jusqu'au 56e jour. L'immunité cellulaire initiée par le vaccin a aussi été étudiée par le dosage de l'interféroninterféron gamma (technique ELIspot) qui témoigne de l'activation spécifique -- et donc de leur prolifération -- des lymphocyteslymphocytes T. Le pic d'activation des lymphocytes T intervient avant celui de la production des IgG, entre le 7e et le 14e jour.
Cet essai clinique indique donc qu'une injection unique de ChAdOx1 induit une immunité cellulaire et humorale contre le SARS-CoV-2 ainsi que des réactions locales et systémiques désagréables mais qui ne sont pas dangereuses. Il ne s'agit là que des résultats de la phase 1/2. Ces résultats ne sont donc encore pas généralisables à tout le monde. Les auteurs indiquent que les volontaires considérés étaient majoritairement blancs, jeunes et en bonne santé. On peut donc s'attendre à des résultats différents pour des personnes âgées, présentant des facteurs de comorbiditécomorbidité ou appartenant à d'autres groupes ethniques. Les essais de phase 3 sont d'ores et déjà lancés au Brésil, en Afrique du Sud et au Royaume-Uni.